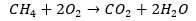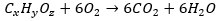Wet van behoud van massa
Het oplossen en kloppend maken van reactievergelijkingen is een veelvoorkomende bezigheid binnen de scheikunde. Het kan soms best lastig zijn om deze reactievergelijkingen aan te pakken. Antoine Lavoisier heeft hier een wet op bedacht, die een goede houvast biedt tijdens het oplossen van de vergelijkingen: de wet van behoud van massa. In dit artikel vertellen we je alles wat je moet weten over de wet van behoud van massa.

Wat is de wet van behoud van massa?

De wet van behoud van massa stelt dat er bij een chemische reactie geen massa verloren gaat. Deze wet wordt ook wel de wet van Lavoisier genoemd. De wet vertelt dat de totale massa van de moleculen die worden gebruikt om een reactie tot stand te laten komen (reagentia), hetzelfde is als de totale massa van de moleculen die door de reactie worden gevormd (reactieproducten).
In vergelijkingsvorm is dat:
min = muit
De wet is sinds zijn uitvinding in 1789 de standaardmanier waarop scheikundigen reactieproducten achterhalen. Je hoeft maar twee dingen te weten om erachter te komen wat de missende reactieproducten zijn:
- De massa van de moleculen vóór de reactie.
- De massa van een paar reactieproducten.
Hoe gebruik je de wet van behoud van massa?

De wet van behoud van massa is een handige tool om reactievergelijkingen kloppend te maken. Als een deel van de reactievergelijking bekend is, kun je de details van de reactie achterhalen.
Voorbeeld:
Bij verbranding van methaan komen CO2 en H2O vrij. Maar in welke verhoudingen gebeurt deze reactie eigenlijk? Daarvoor kan de wet van behoud van massa worden gebruikt. De reactievergelijking ziet er dan als volgt uit:
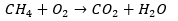
In de vergelijking is te zien dat er aan de linker- en rechterkant niet evenveel van alle atomen staan. Rechts staan er twee waterstofatomen en links vier. Ook staan er rechts drie zuurstofatomen en links maar twee. Het aantal koolstofatomen klopt wel. Doordat er verschillen zijn tussen beide kanten klopt de totale balans niet. Volgens de wet van behoud van massa moet de massa aan beide kanten gelijk zijn. Van elk atoom moet er vóór de pijl evenveel zijn als na de pijl.
Een goede strategie hiervoor is om te kijken naar welke atomen er aan de linkerkant te veel zijn en dat vervolgens te compenseren aan de rechterkant. In dit geval zien we twee waterstofatomen te veel vóór de pijl. Daarom moeten er na de pijl niet één, maar twee watermoleculen staan:
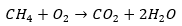
Wanneer de balans dan opnieuw wordt opgemaakt, staan er aan de linkerkant nog twee zuurstofatomen en aan de rechterkant vier (twee van CO2 en twee van 2H2O). Er moeten aan de linkerkant twee zuurstofatomen bij, oftewel een zuurstofmolecuul:
Nu klopt de reactievergelijking weer.
Vragen over reactievergelijkingen kunnen ook op een andere manier worden gesteld. In het volgende voorbeeld wordt een molecuul (bestaande uit zuurstof-, waterstof- en koolstofatomen) verbrand volgens de volgende reactievergelijking:
Voorbeeld:
Wat moet er op de plekken x, y en z staan?
Voor het gemak lossen we hem in alfabetische volgorde op. Om te beginnen met het aantal koolstofatomen dat het molecuul bevat, kijken we naar het verschil tussen het aantal koolstofatomen aan de linker- en rechterkant van de pijl.
Er is te zien dat er zes CO2 atomen staan, met in totaal zes koolstofatomen. Aan de linkerkant staan geen andere koolstofatomen, hierdoor heeft het molecuul zes koolstofatomen: x = 6.
Het aantal waterstofatomen in het molecuul kan op een soortgelijke manier worden opgelost. Rechts van de pijl zijn in totaal 6 · 2 = 12 waterstofatomen en links verder geen: y = 6.
Het aantal zuurstofatomen in het molecuul is iets ingewikkelder. Rechts van de pijl staan 6 · 2 + 6 = 18 zuurstofatomen. Aan de linkerkant staan er zes zuurstofmoleculen: 6 · 2 = 12 zuurstofatomen. Het aantal zuurstofatomen in het molecuul is het verschil hiertussen: z = 18 - 12 = 6.
Het molecuul heeft dan de molecuulformule C6H12O6, beter bekend als de formule van glucose.
De strategie voor het kloppend maken van reactievergelijkingen kan verschillend zijn. Het is belangrijk om goed te kijken naar atomen waarvan er te weinig zijn. Begin daarna met het kloppend maken met het betreffende molecuul.
Klopt de wet van behoud van massa altijd?
Ondanks bepaalde tegengestelde beweringen klopt de wet van behoud van massa eigenlijk altijd. Het kan echter voorkomen dat de hoeveelheid massa van de moleculen vóór en na de reactie niet precies hetzelfde is. De reden daarvoor is dat een reactie eigenlijk altijd wel energie kost, of dat er energie bij vrijkomt. Denk aan de verbranding van een kaars. Daar komt energie bij vrij in de vorm van lichtstralen, waardoor de reactieproducten minder zwaar zijn dan de reagentia.
Echter, als we kijken naar Albert Einsteins bekendste wet, E = mc2, betekent dat niet dat de wet van behoud van massa niet klopt. Einsteins wet staat voor de vergelijking van energie en massa. In deze formule staat dat energie gelijk is aan massa en andersom. De lichtstralen, die bij het verbranden van de kaars ontsnappen, kunnen ook worden gezien als deeltjes met een bepaalde massa. De reagentia hebben hier dan dezelfde massa als de reactieproducten plus de lichtdeeltjes.
Lichtdeeltjes worden vaak niet in de reactievergelijking genoemd, wat leidt tot de conclusie dat de wet van behoud van massa niet helemaal klopt. Maar door de lichtdeeltjes mee te nemen in de vergelijking klopt de wet van behoud van massa altijd.
Voor het kloppend maken van reactievergelijkingen hoeft hier eigenlijk nooit rekening mee te worden gehouden. Het bovenstaande voorbeeld voor het kloppend maken van een reactievergelijking is dan ook nog steeds correct.
Video
Wil je alles over de wet van behoud van massa nog even terugzien? Bekijk dan deze video: