Redoxreacties
Heb je je ooit afgevraagd wat er precies in een accu of een batterij gebeurt wat ervoor zorgt dat er stroom geleverd kan worden? Of heb je je wel eens afgevraagd waardoor ijzer roest? Het heeft allemaal te maken met één specifiek soort reactie, namelijk redoxreacties. In dit artikel leggen we je uit hoe redoxreacties precies werken.

Wat zijn redoxreacties?

Een redoxreactie is de reactie tussen een reductor en een oxidator, waarbij elektronen worden overgedragen van de reductor naar de oxidator. Anders gezegd: redoxreacties zijn reacties tussen atomen, moleculen en/of ionen, waarbij een elektron uit zijn schil springt en terecht komt in de schil van een ander atoom, wat zorgt voor een veranding in lading.
Om dit goed te begrijpen is het allereerst belangrijk om te weten dat er in atomen altijd lading zit opgeslagen. Deze lading zit opgeslagen in hele kleine deeltjes. Om je hier iets bij voor te stellen, kun je de afbeelding hieronder bekijken. De structuur die je in de afbeelding ziet, noemt men het atoommodel van Rutherford. Zoals je in dit model kunt zien, zit er in het midden van een atoom de atoomkern. Hier zijn de protonen en neutronen in opgeslagen. Protonen zijn hele kleine positief geladen deeltjes en neutronen zijn hele kleine deeltjes zonder een lading, oftewel neutraal geladen. Om de atoomkern zitten cirkels, dit zijn elektronenschillen. De naam zegt het eigenlijk al, hier zitten de elektronen die bij het atoom horen opgeslagen. Deze draaien met een enorme snelheid om het atoom heen. Ze zijn altijd in beweging.
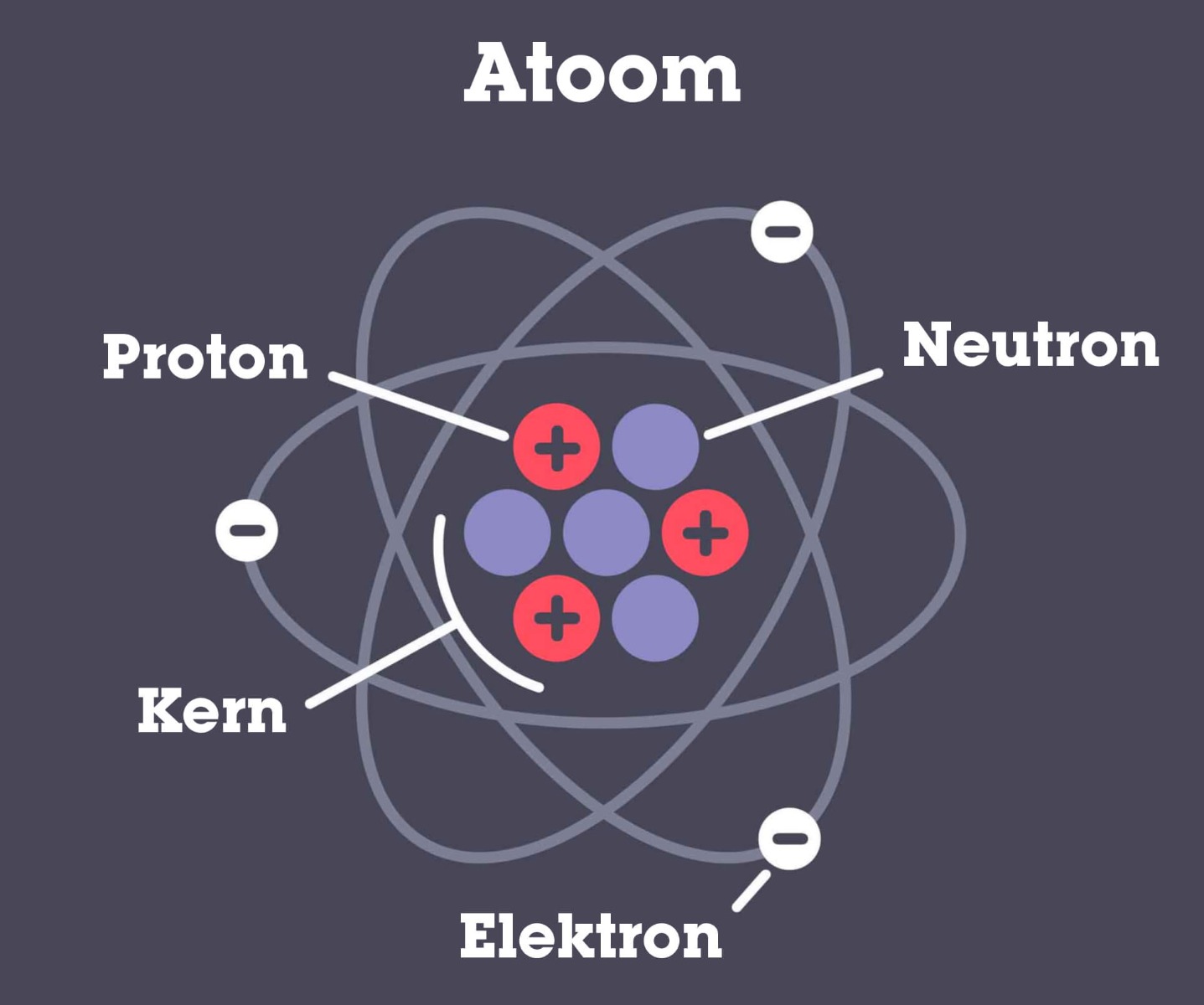
De lading in een atoom is dus verdeeld in negatieve en positieve deeltjes. De protonen zijn positief geladen en de neutronen zijn neutraal geladen. Om de positieve lading in de kern te compenseren, zijn de elektronen altijd negatief geladen deeltjes. Nu zitten de protonen helemaal vast in de kern en bewegen de elektronen rond in de elektronenschillen. De protonen zitten dus vast op hun plek, maar het kan voorkomen dat een elektron uit zijn eigen schil springt. Dit elektron komt dan in de schil van een ander atoom terecht, waardoor er een verandering in lading op zal treden. Dit noemt men een redoxreactie.
Als een elektron naar een andere schil springt, laat het atoom dus eigenlijk één van zijn elektronen los. Het atoom waar dit elektron zich vervolgens vestigt, neemt dit elektron op. Het atoom dat een elektron los laat noem je de reductor en het atoom dat een elektron opneemt noem je een oxidator.
Ezelsbruggetje: Oxidator = Opnemen
Wat is een reductor?

De reductor is een atoom dat een elektron kan afstaan. Hier springt het elektron uit de elektronenschil. Een voorbeeld van een reactie van een reductor (Natrium) zie je hieronder:
Na ⇒ Na+ + e−
Natrium is het atoom dat een elektron afstaat in deze reactie. Omdat er een elektron wordt afgestaan, gaat er negatieve lading af en verdwijnt de neutrale lading van het Natrium atoom, waardoor het atoom na reductie positief geladen is. Reductie is een algemeen woord voor stoffen die elektronen afstaan. Er zit een groot verschil in de mate waarin reductoren hun elektronen afstaan. Een reductor is sterk als het graag elektronen wilt afstaan. Dit noem je een sterke reductor. Een reductor is zwak wanneer het zijn elektronen wel wilt afstaan, maar in mindere mate dan bij een sterke reductor het geval is. Daarom noem je dit een zwakke reductor. Omdat natrium (Na) graag elektronen afstaat, wordt het een sterke reductor genoemd.
Wat is een oxidator?

Een oxidator is een atoom dat juist een elektron kan opnemen. Het elektron dat uit de schil van een ander atoom is gesprongen, springt op de schil van een oxidator. Een voorbeeld van een oxidator (chloride) zie je hieronder:
Cl2 + 2e− ⇒ 2Cl−
Cl2 is het atoom dat een elektron opneemt in deze reactie. Omdat er een elektron wordt opgenomen, komt er negatieve lading bij. Dit zorgt ervoor dat de neutrale lading verdwijnt. Dit kun je zien aan de bovenstaande reactie. Voor de pijl heeft chloride een neutrale lading en na de pijl een negatieve lading. Dit noem je oxidatie. Ook bij oxidatoren zit er een groot verschil in de mate waarin de oxidatoren elektronen opnemen. Een oxidator is sterk als het graag elektronen wilt opnemen. Dit heet een sterke oxidator. Een oxidator is zwak wanneer het elektronen wel kan opnemen, maar dat moeilijker gaat dan bij een sterke oxidator. Daarom noem je dit een zwakke oxidator. Zoals je in het voorbeeld kunt zien, wilt chloride graag elektronen opnemen en daarom is het dus een sterke oxidator.
Er zijn nu twee voorbeelden gegeven waarin natrium en chloride als reductor en oxidator worden beschreven. Nu is natrium een metaal en chloride een niet-metaal. Metalen zijn over het algemeen sterke reductoren en niet-metalen zijn sterke oxidatoren. Als je meerdere oxidatoren en reductoren in een mengsel met elkaar laat reageren, zal de sterkste reductor met de sterkste oxidator reageren. Je kan een lijst waarin de oxidatoren en reductoren staan gerangschikt vinden in Binas tabel 48A.
Deze reacties kan je laten zien in reactievergelijkingen. Hieronder lees je daar meer over.
Reactievergelijking van een redoxreactie opstellen
Redoxreacties zet je in reactievergelijkingen door gebruik te maken van halfreacties en totaalreacties. De namen zeggen het eigenlijk al: in de halfreactie staat de helft van de reactie en in de totaalreactie staat de hele reactie. Er worden uiteindelijk twee halfreacties opgesteld waarvan je de uiteindelijke totaalreactie kan maken. Bij elektrochemische cellen worden deze halfreacties van elkaar gescheiden, terwijl dat bij redoxreacties niet het geval is. Het kan handig zijn om van het volgende stappenplan gebruik te maken bij het opstellen van reactievergelijkingen voor redoxreacties:
- Schrijf alle losse oxidatoren en reductoren op
- Vind de sterkste oxidator en reductor met behulp van Binas tabel 48A
- Schrijf de halfreacties van de sterkste oxidator en reductor op
- Maak het aantal elektronen gelijk
- Tel de halfreacties bij elkaar op
- Streep alle gelijksoortige deeltjes links en recht van de pijl weg en zorg dat de totale lading voor en na de pijl hetzelfde is
Voorbeeld
Stel, we hebben een oplossing van zink (Zn) en zoutzuur (HCl). Hoe zou de totaalreactie van de redoxreactie er uiteindelijk uit komen te zien?
Alle losse oxidatoren en reductoren zijn Zn, H+ en Cl−. Met behulp van Binas tabel 48A vinden we dat Zn de sterkste reductor is en H+ de sterkste oxidator. De halfreacties zijn als volgt:
Oxidator: 2 H+ + 2e− ⇒ H2
Reductor: Zn ⇒ Zn2+ + 2e−
Vervolgens maak je het aantal elektronen gelijk. In dit voorbeeld is het aantal elektronen in de oxidatiereactie al gelijk aan die van de reductiereactie. Je kunt de halfreacties nu dus bij elkaar optellen:
2 H+ + 2e− + Zn ⇒ H2 + Zn2+ + 2e−
Dan is het nu een kwestie van het wegstrepen van alle gelijksoortige deeltjes links en rechts van de pijl. De lading voor de pijl en na de pijl zijn in totaal beide 2+:
2 H+ + 2e− + Zn ⇒ H2 + Zn2+ + 2e−
Zo kom je uiteindelijk op de volgende totaalreactie uit:
2 H+ + Zn ⇒ H2 + Zn2+
Video
Wil je meer weten over redoxreacties? Check dan onderstaande uitlegvideo van docent scheikunde Sieger Kooij.