Atomen (uitleg)
Atomen, die dingen waarvan alles gemaakt is. Wat zijn het precies, waar bestaan ze uit en hoe zijn ze opgebouwd? In dit artikel lees je alles wat je over atomen moet weten.

Video
Wil je meer weten over atomen? Kijk dan onderstaande video van Scheikundelessen.
De geschiedenis van het atoom

De naam atoom komt van het Griekse woord atomos, wat onsplijtbaar betekent. Een goed gekozen naam, omdat toen gedacht werd dat atomen de kleinste bouwstenen van materie te zijn. Tegenwoordig weten we dat dat niet zo is door jarenlang onderzoek. Het is nu bekend dat atomen een interne structuur hebben. Mensen die meegewerkt hebben aan het huidige model van het atoom zijn onder andere John Dalton, Amedeo Avogadro, J. J. Thomson, Ernest Rutherford en natuurlijk Niels Bohr waar we het huidige model nog steeds aan te danken hebben.
Thomson bedacht het allereerste model van het atoom, ook wel bekend als het krentenbolmodel. Het model van Thomson zag het atoom als een grote klomp materie met een positieve lading waarin kleine deeltjes met een negatieve lading rondzweven, een beetje zoals een krentenbol.

Thomsons krentenbolmodel werd verbeterd door Rutherford naar aanleiding van experimenten uitgevoerd door Geiger en Marsden waarin zware geladen deeltjes, tegenwoordig bekend als α-deeltjes, op een dunne folie van goud werden geschoten. In het model van Thomson zouden alle deeltjes precies rechtdoor moeten gaan, zelfs als ze door het goudfolie heen zouden zijn gegaan. Dit was niet het geval. Het bleek namelijk dat α-deeltjes in alle richtingen werden weerkaatst door de goudatomen. Rutherford interpreteerde dit en bedacht dat een atoom zou moeten bestaan uit een zware kern waarin alle positieve lading zich zou bevinden en de elektronen, de deeltjes met de negatieve lading uit Thomsons model, er in een wolk omheen zouden bewegen.
Rutherfords model werkte goed, tot de opkomst van kwantummechanica in 1910 en later. Niels Bohr zag twee grote problemen in het model van Rutherford, namelijk: een elektron dat om een geladen kern zou bewegen gedoemd was om in de kern te storten door de aantrekkende kracht tussen het elektron en de kern. Het tweede probleem was het feit dat atomen zeer selectief straling kunnen absorberen en uitstralen. Bohr’s oplossing was simpel: het elektron kan alleen om de atoomkern heen draaien op zeer specifieke afstanden. Deze afstand werd bepaald door de energie van het elektron en de lading van de atoomkern.
Zie het figuur hieronder voor het verschil tussen het atoommodel van Thomson, Rutherford en Bohr:
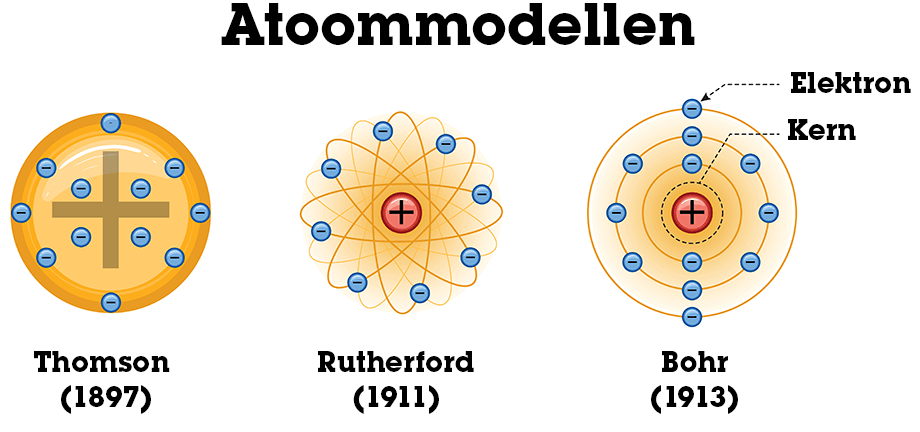
Opbouw van het atoom

We weten dus dat atomen niet de kleinste bouwstenen van materie zijn, ze hebben een interne structuur waar veel over te leren valt. Een atoom bestaat uit een kern waaromheen de elektronen bewegen. Elektronen zijn heel erg licht vergeleken met de atoomkern en hebben een negatieve lading. De atoomkern is zwaar en heeft een positieve lading, maar is opgebouwd uit twee delen: neutronen en protonen. Protonen hebben een positieve lading en zijn meer dan 1000 keer zwaarder dan elektronen. Neutronen zijn neutraal geladen en een heel klein beetje zwaarder dan protonen. Het aantal protonen in de kern en elektronen die om de kern bewegen is gelijk aan elkaar. Dit zorgt voor een neutraal geladen atoom. Als je één van de elektronen zou weghalen, krijgt het atoom een lading en noemen we het een ion.
Het aantal protonen in de atoomkern wordt weergegeven in het atoomnummer, Z, van een atoom. Het aantal neutronen in de kern wordt aangegeven met de letter N. Het massagetal A van een atoom krijg je door het aantal protonen en neutronen bij elkaar op te tellen: A = N + Z. Het soort atoom wordt alleen bepaald door het aantal protonen wat in de kern zit, het aantal neutronen maakt niks uit. Zo kan het dus zijn dat hetzelfde atoom gevonden kan worden met een hoger of lager massagetal omdat er meer of minder neutronen in de kern aanwezig zijn. Atomen met hetzelfde atoomnummer maar een ander massagetal noemen we isotopen.
Lange tijd werd er gedacht dat protonen en neutronen niet op te delen zijn, maar zelfs deze kleine deeltjes zijn opgebouwd uit nog kleinere deeltjes. Deze deeltjes noemen we quarks en worden beschreven in het standaardmodel. Elektronen zijn ook opgenomen in het standaardmodel omdat het nog niet is gelukt om deze verder op te delen. Het standaardmodel is een uitgebreid natuurkundig model dat Einstein’s relativiteit combineert met kwantummechanica en alle processen beschrijft die op de allerkleinste schaal kunnen gebeuren. Het is voorlopig erg succesvol in het leveren van voorspellingen voor de uitkomst van experimenten, maar er is altijd de mogelijkheid dat er nog kleinere deeltjes bestaan dan beschreven worden met het standaardmodel.









