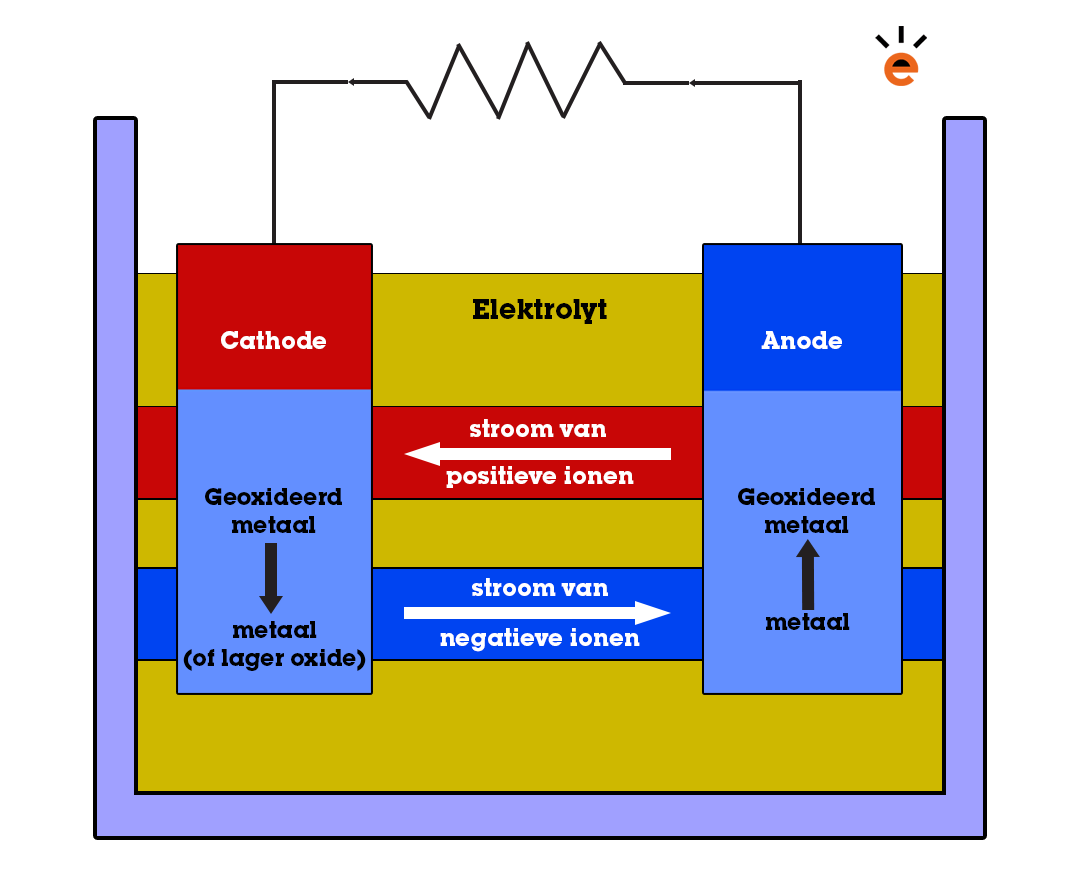
Elektrochemische cel
Handig he, dat scherm waar je dit nu op leest? Of wat dacht je van je bureaulamp als je 's avonds licht nodig hebt tijdens het leren? Deze zaken maken gebruik van elektrochemische cellen. In dit artikel lees je wat elektrochemische cellen precies zijn en hoe ze werken.

Wat is een elektrochemische cel?

Een elektrochemische cel is een opstelling waarmee stroom gegenereerd kan worden. De bekendste vorm van een elektrochemische cel is een batterij. Net als in een volledige redoxreactie, zijn er in een elektrochemische cel twee halfreacties aanwezig. Echter, zijn deze twee halfreacties, in tegenstelling tot de situatie bij een redoxreactie, van elkaar gescheiden.
Hoe werkt een elektrochemische cel?

In de afbeelding hieronder zie je één van de eerst ontwikkelde elektrochemische cellen, ook wel de Daniell cell genoemd. In de afbeelding zie je dat de twee halfreacties van elkaar gescheiden zijn. Ze vinden elk in een aparte reactiebuis plaats. Maar om de redoxreactie wel te laten verlopen, zal er een manier moeten zijn waarop de elektronen zich kunnen verplaatsen. Dat kan onder andere doordat de reactiebuizen zijn verbonden met een voltmeter. Via deze draad kunnen de elektronen die loskomen bij de redoxreactie, zich verplaatsen.
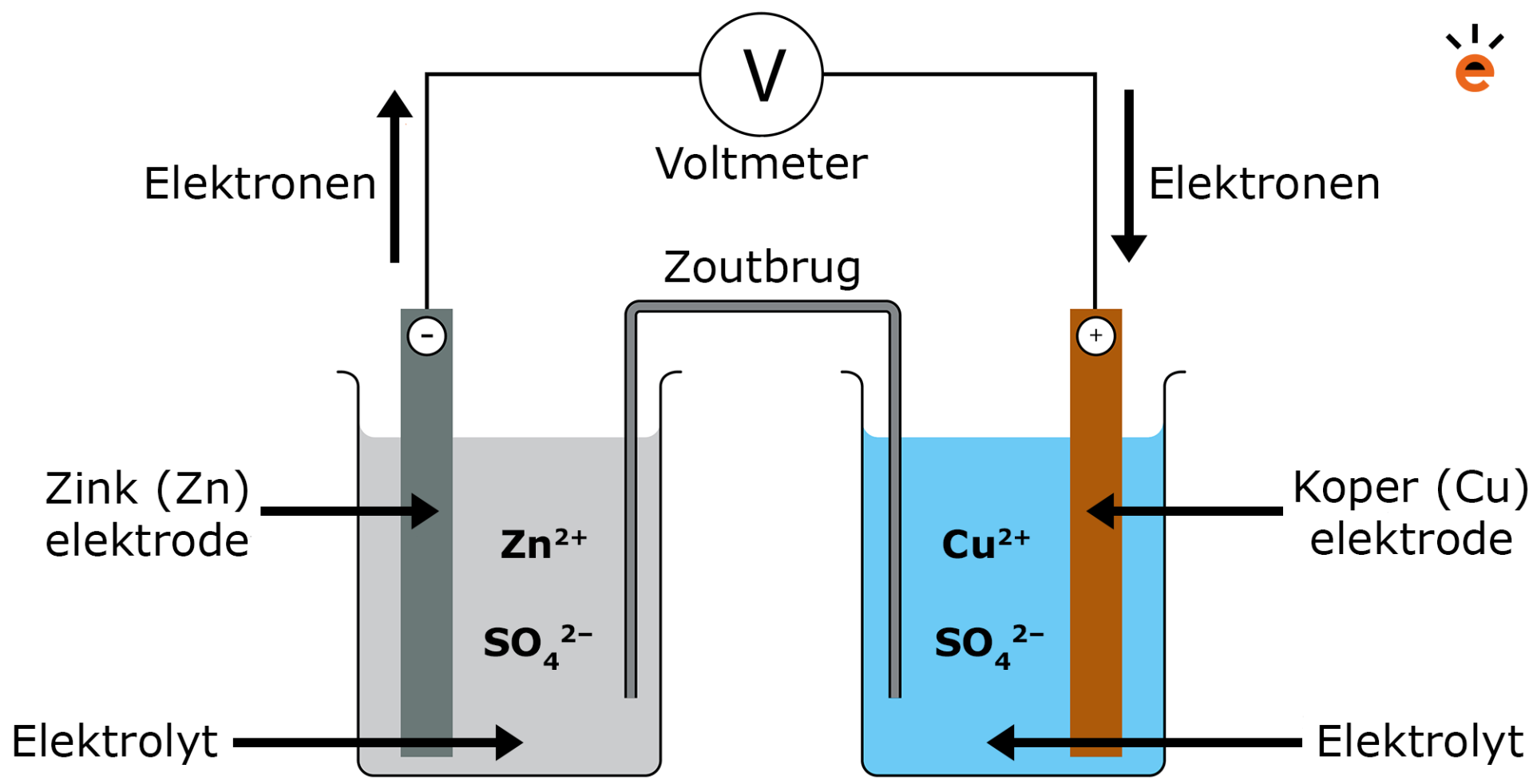
In de elektrochemische cel op de afbeelding zie je links de anode van zink (Zn) die dient als de reductor en rechts de cathode van koper (Cu) die dient als oxidator. Zowel bij de anode als bij de cathode vindt er een halfreactie van de redoxreactie plaats.
De halfreacties zijn:
- Zn(s) <> Zn2+ + 2e−
- Cu2+ + 2e− <> Cu(s)
Zink zal als reductor elektronen afstaan en deze zullen via de draad van de voltmeter naar de andere reactiebuis lopen waar ze vervolgens door het koper geoxideerd worden. De elektronen verplaatsen zich op deze manier vanwege het volgende:
- De elektronen die vrijkomen in de zink-oplossing zullen zich naar het eerste deel van de stroomdraad verplaatsen. Dit deel van de stroomdraad raakt daardoor een beetje negatief geladen. Aan de andere kant, zullen de elektronen in de stroomdraad bij de koper-oplossing weggetrokken worden. Hierdoor raakt dit deel een beetje positief geladen. Door dit verschil in lading kunnen de elektronen zich verplaatsen.
Om de stroomkring compleet te maken, is het essentieel om de stroomkring te sluiten. Dit gebeurt door middel van een zoutbrug of een poreuze wand. In de afbeelding wordt er gebruikgemaakt van een zoutbrug. Hiervoor wordt vaak een simpel rubber buisje gebruikt met een gel erin. In deze gel zitten positieve en negatieve ionen die zich naar beide oplossingen kunnen verplaatsen. De gel zorgt ervoor dat de ionen niet in één keer alle kanten op zullen vliegen. Het doel van de zoutbrug is dat de lading behouden blijft.
- In de zoutbrug gaan de negatieve ionen naar de reductor oplossing, omdat hier Zn2+ zorgt voor een positieve lading. Andersom gaan de positieve ionen naar de Cu(s)-kant om de lading van de elektronen die hier komen te compenseren.
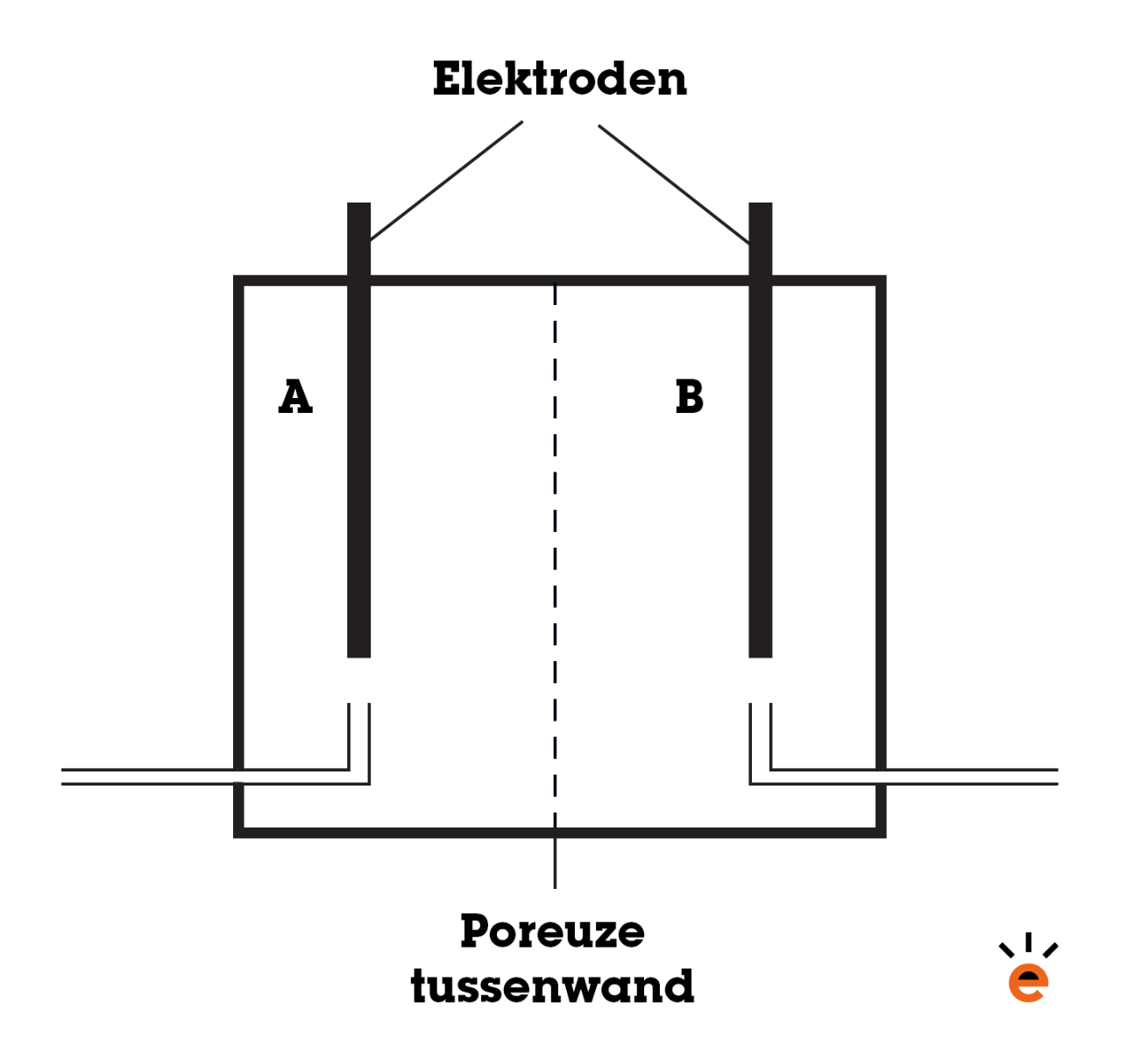
Naast een zoutbrug kun je ook een poreuze tussenwand gebruiken om ionen tussen twee oplossingen te verplaatsen. Nu worden beide oplossingen in één reageerbuis gedaan, terwijl er in het midden een dunne wand geplaatst zal worden die bepaalde ionen wel doorlaat en andere ionen niet. Zie de afbeelding hieronder.
Wat is bronspanning?
Bronspanning is de spanning die door de elektrochemische cel wordt geleverd. Dit is het verschil in de elektrodepotentialen van de reductor en oxidator. In een formule:
ΔV = VOX − VRED
Als de reductor een potentiaal van -0,79 V heeft en de oxidator een potentiaal van +0,31 V, dan is de bronspanning gelijk aan +0,32 – (-0,79) = 1,11 V.
Naarmate de batterij stroom levert, zal dit verschil veranderen. Het evenwicht van de zink-reactie zal naar links verschuiven, waardoor er minder vrije elektronen beschikbaar zullen zijn. Dit zorgt ervoor dat de elektrode minder negatief wordt. Het evenwicht van koper zal naar links verschuiven, waardoor er meer elektronen beschikbaar zijn. De elektrode zal hierdoor minder positief worden. Dit betekent dat het verschil na een tijdje steeds kleiner wordt. Uiteindelijk zal de bronspanning gelijk zijn aan 0, wat betekent dat de batterij leeg is.
Hoe werkt een oplaadbare accu?
De elektrochemische cel die je hierboven hebt gezien is een niet-oplaadbare batterij. Om jouw mobieltje elke keer opnieuw van stroom te kunnen voorzien, zal er nog iets anders in de accu moeten gebeuren. De reactie die hierboven is beschreven, zal omgekeerd moeten verlopen. Hierdoor worden de elektronen weer geabsorbeerd, en zullen ze vervolgens weer los kunnen komen van de reductor om een stroom te laten verlopen.
In de afbeelding hierboven kun je zien dat de anode en cathode in een vloeistof hangen. Deze vloeistof noem je het elektrolyt. Deze vloeistof heeft dezelfde functie als de zoutbrug en het poreuze membraan. Het zorgt er dus voor dat positieve en negatieve ionen de lading kunnen compenseren. Beide staven zijn van metalen gemaakt. In een autoaccu zijn deze twee staven van lood (Pb) gemaakt waarvan één staaf een extra laag van lood(IV)oxide (PbO2) bevat. Het elektrolyt is een zwavelzuuroplossing (H2SO4). Op deze manier vinden weer twee halfreacties plaats:
Positieve elektrode:
PbO2 (s) + SO42– + 4 H+ + 2 e– → PbSO4 (s) + 2 H2O (l)
Negatieve elektrode:
Pb (s) + SO42– → PbSO4 (s) + 2 e–
Op de positieve elektrode vindt de reductie plaats en op de negatieve elektrode de reductie. Nu zal het positief geladen Pb2+ direct reageren met SO42– , het elektrolyt. Dit vormt zich direct tot PbSO4 op de loodplaat. Daardoor is het mogelijk om de accu ook op te laden. Als de accu nu weer wordt opgeladen, wordt het PbSO4 weer opgesplitst door middel van elektrolyse. De reacties die nu plaatsvinden zijn gelijk aan de omgekeerde reacties van de stroomlevering:
Positieve elektrode (elektrolyse):
PbSO4 (s) + 2 H2O (l) → PbO2 (s) + SO42– + 4 H+ + 2 e–
Negatieve elektrode (elektrolyse):
PbSO4 (s) + 2 e– → Pb (s) + SO42–
Zoals je in de reacties ziet zijn ze omgekeerd aan de stroomlevering. Nu reageert de positieve elektrode als een reductor en de negatieve elektrode als een oxidator. Een essentiële voorwaarde om de accu op te laden is dat de ladingsspanning gelijk is aan of groter is dan de bronspanning.
Video
Wil je nog meer uitleg over de elektrochemische cel? Dan is onderstaande uitlegvideo van Scheikundelessen zeker het kijken waard!