Isomeren
Veel mensen denken dat twee stoffen hetzelfde zijn als er dezelfde atomen in deze twee stoffen zitten. Echter zit er vaak nog een verschil in de structuur van de stoffen, waardoor ze toch verschillend zijn. Dit noemt men isomerie. In dit artikel kun je daar alles over lezen.
Wat zijn isomeren?

Isomeren zijn stoffen met dezelfde molecuulformule, maar met een andere structuurformule. Het is hierbij dus belangrijk dat je het verschil kent tussen molecuul- en structuurformules. Isomeren worden ook wel structuurisomeren genoemd. De soort en het aantal atomen die in beide stoffen voorkomen zijn precies hetzelfde, echter verschilt de structuur. Dat komt doordat de atomen onderling op een andere manier verbonden zijn. Omdat de stoffen zo op elkaar lijken, zijn ze soms lastig van elkaar te onderscheiden en lijken de eigenschappen ook vaak op elkaar.
Als je bijvoorbeeld kijkt naar de stof C5H12: hoeveel verschillende mogelijke structuren zijn er dan? Hieronder behandelen we drie verschillende mogelijke structuren voor C5H12.
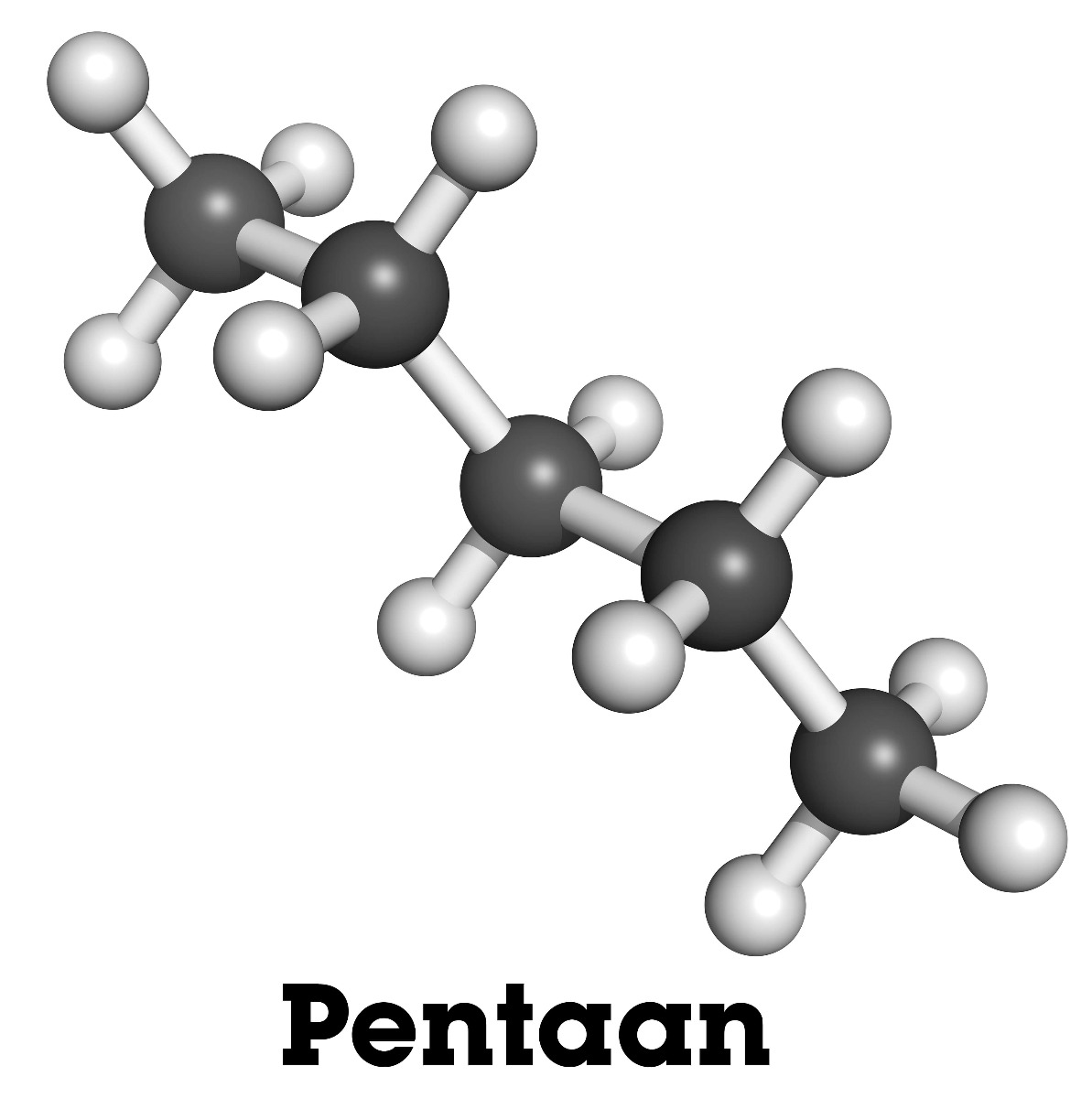
Hierboven zie je pentaan. Alle C-atomen zitten in één lange tak aan elkaar verbonden.
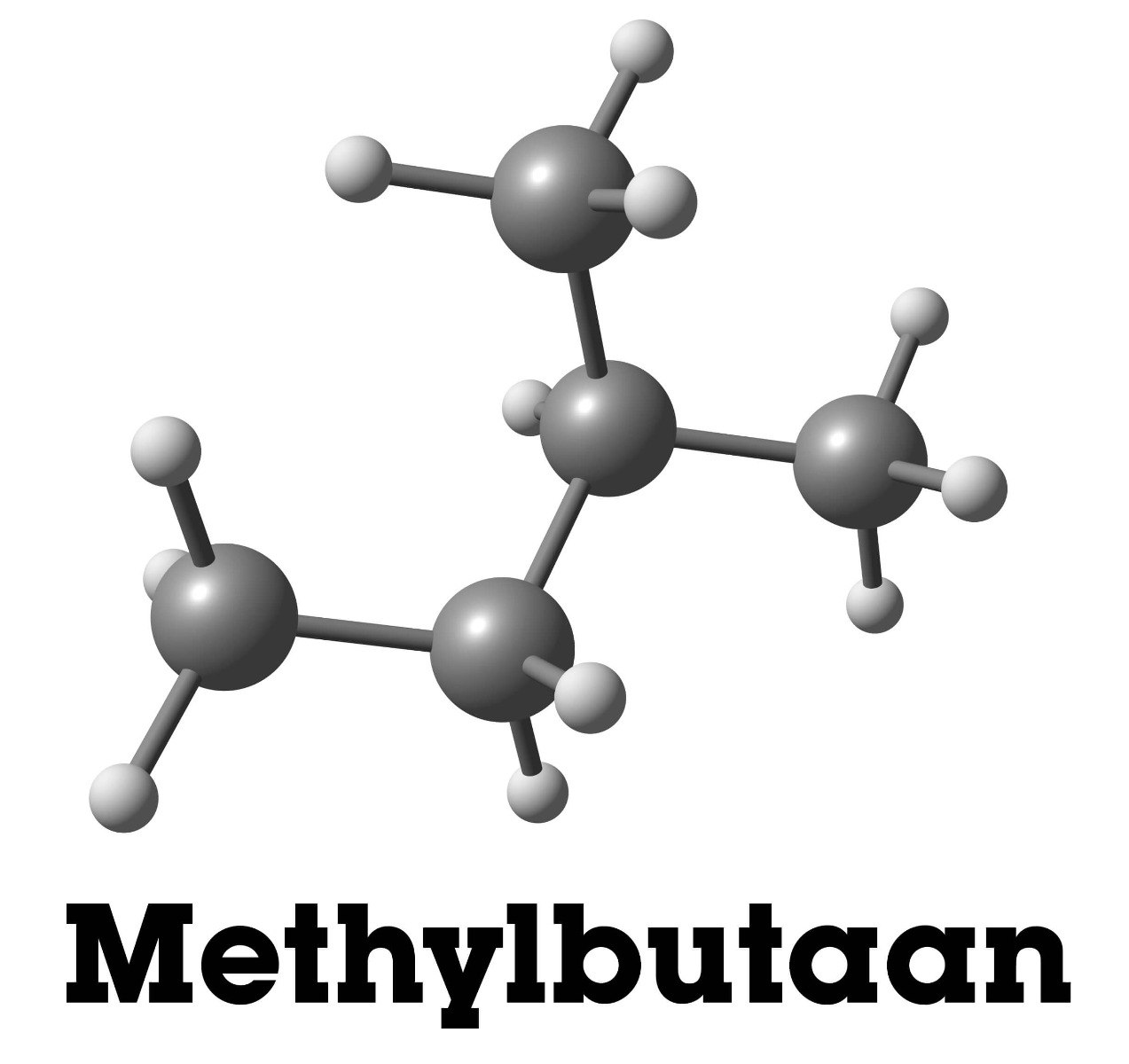
Hierboven zie je methylbutaan, waarbij er één vertakt C-atoom aan de langere C-keten zit. De molecuulformule blijft C5H12.
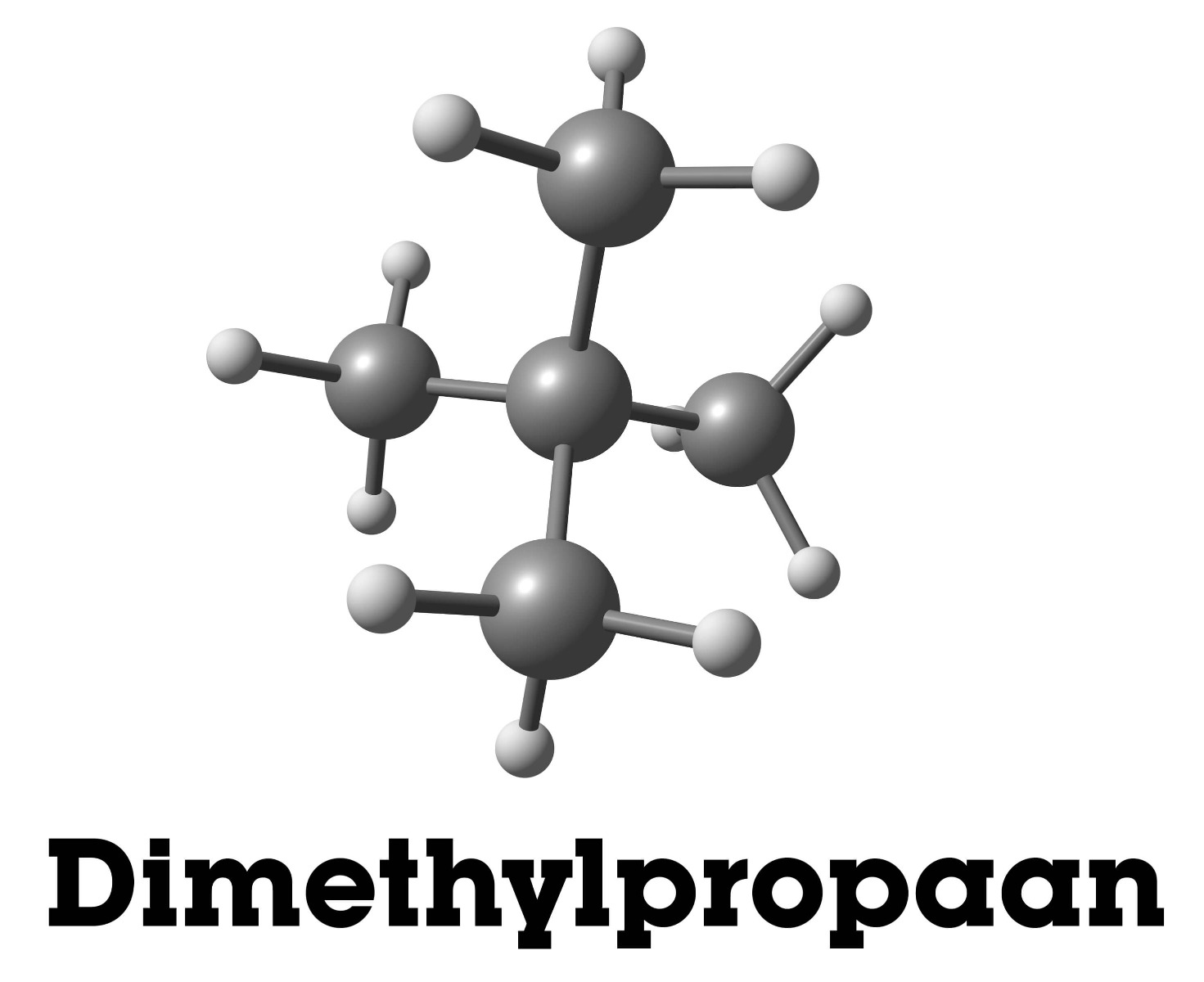
De isomeer die je hierboven ziet is dimethylpropaan en je ziet dat er twee vertakte C-atomen in het molecuul aanwezig zijn. Maar nog steeds blijft de molecuulformule C5H12.
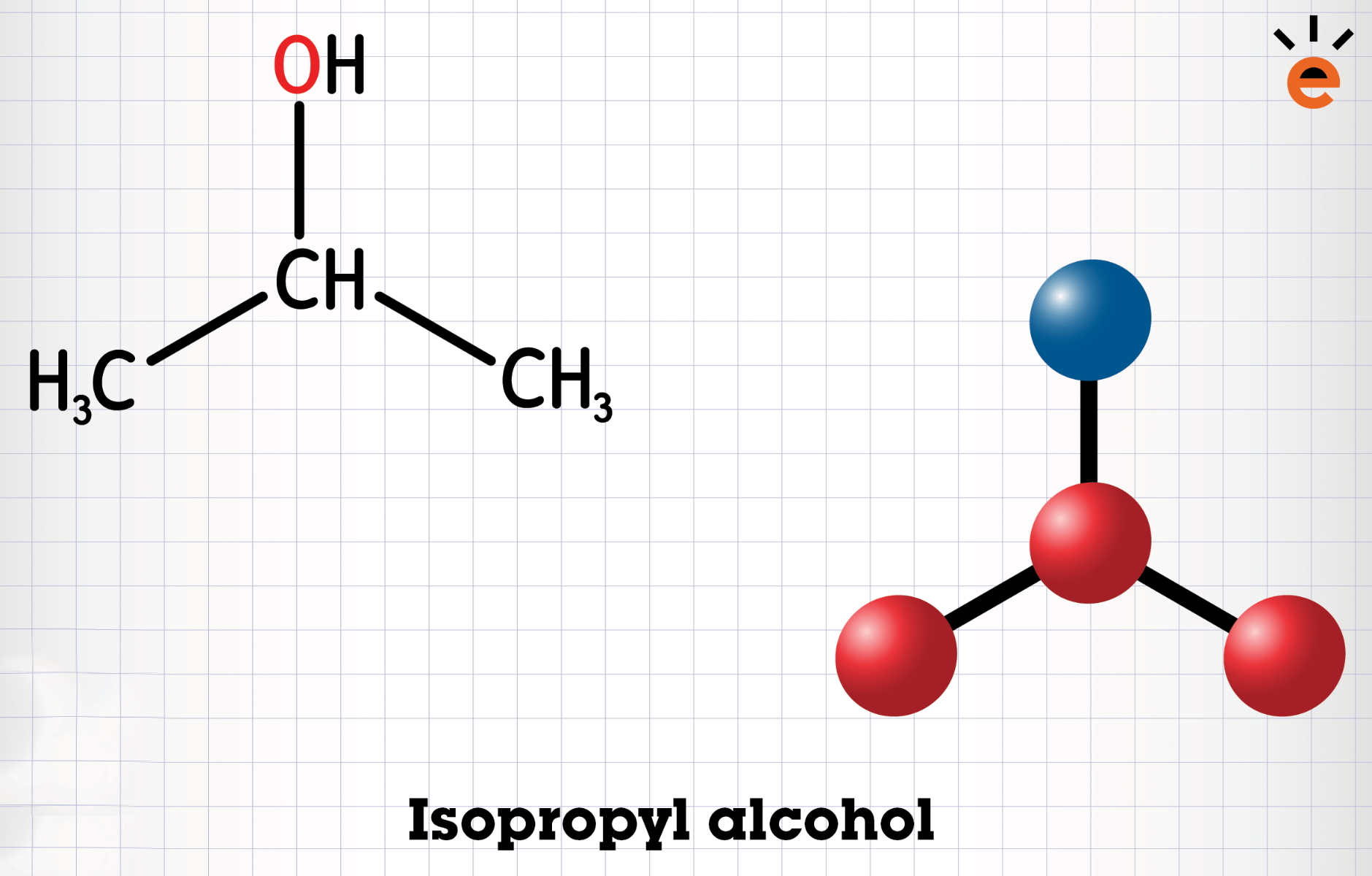
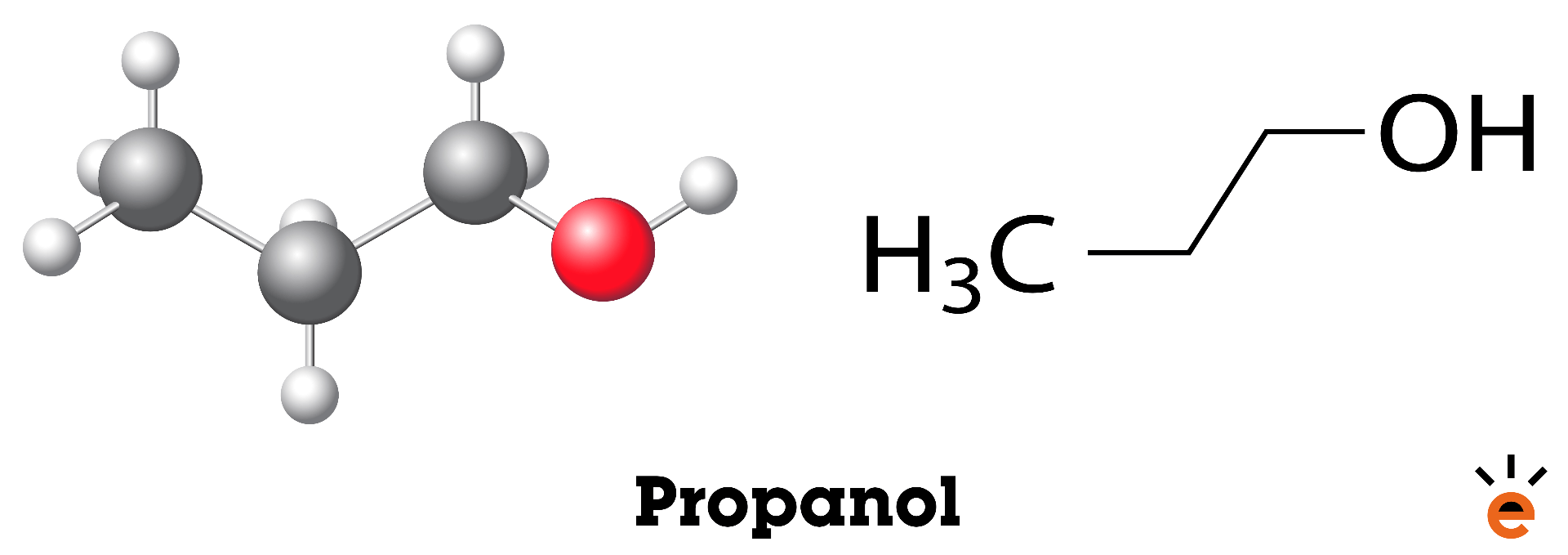
De drie bovengenoemde stoffen zijn allemaal structuurisomeren van elkaar doordat de volgorde van de atomen van elkaar verschillen. In deze voorbeelden zijn de C-atomen op verschillende manieren vertakt. Er kunnen ook andere soorten atomen in het molecuul voorkomen waardoor het isomeren worden. Er kan bijvoorbeeld een OH-groep in het molecuul voorkomen die zich op verschillende plekken kan binden. Kijk maar eens naar propanol in de afbeelding hieronder. De OH-groep kan aan het middelste (tweede) C-atoom zitten of aan één van de buitenste C-atomen. Hierdoor worden deze twee stoffen ook structuurisomeren van elkaar.
Daarnaast kunnen isomeren ontstaan doordat er een verschil in ruimtelijke ordening aanwezig is. Dit noemt men stereo-isomerie. Voorbeelden van stereo-isomerie zijn cis-trans-isomerie en optische isomeren.
Wat is cis-trans-isomerie?
Cis-trans-isomerie kan ontstaan als een stof dubbele bindingen bevat of een ringstructuur heeft, waardoor er atomen aan weerszijden van elkaar kunnen gaan liggen. Bij cis-isomeren zijn deze atomen aan dezelfde kant gevestigd en bij trans-isomeren aan elkaars weerszijde.
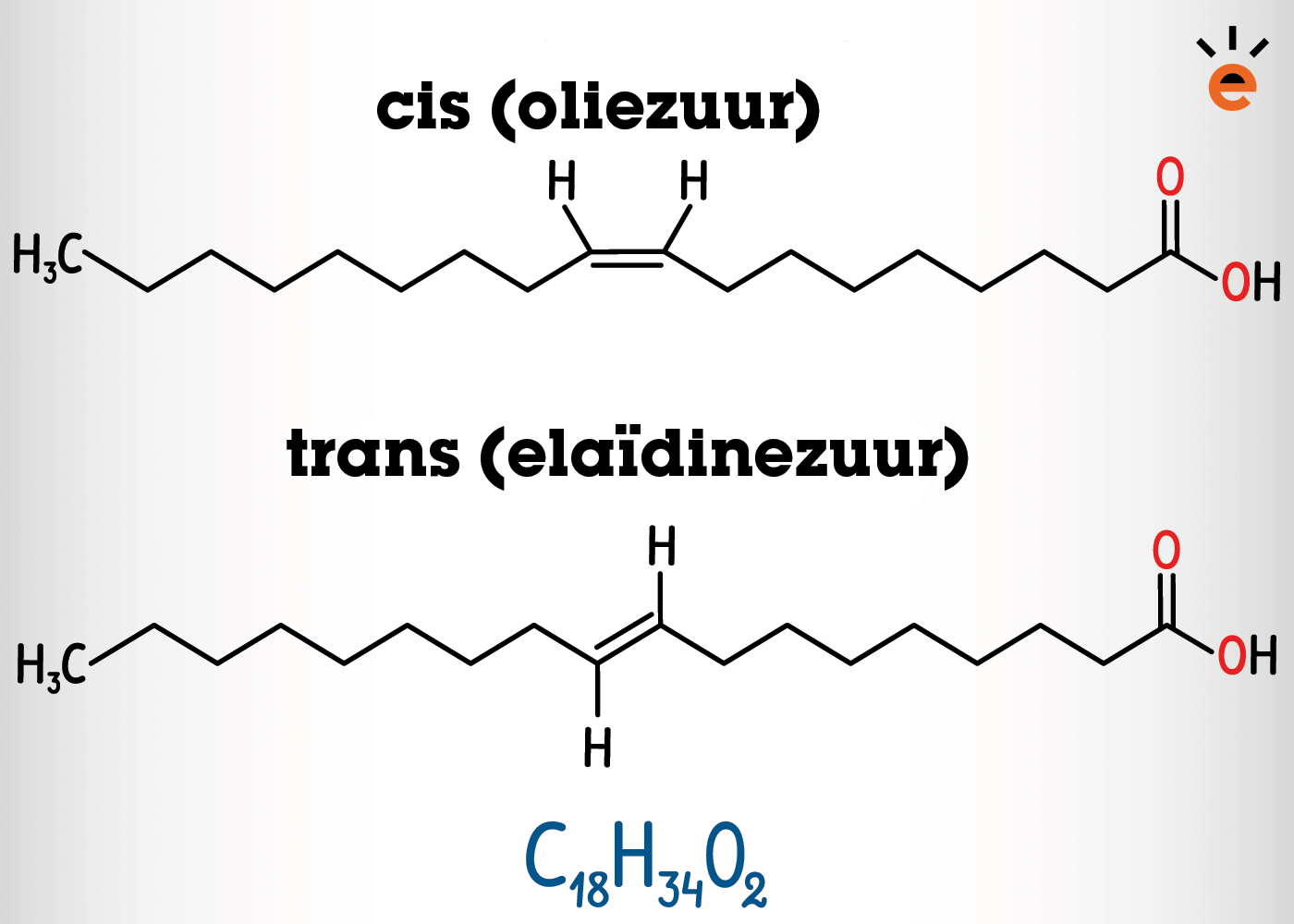
Zoals je misschien weet hebben vetten hele lange ketens, en als ze onverzadigd zijn hebben ze één of meerdere dubbele bindingen. Dat betekent dat er cis-trans-isomerie kan optreden. Bekijk de afbeelding hieronder maar eens:
In het bovenste vetzuur zitten de waterstofatomen aan dezelfde kant van de dubbele binding, dit is dus een cis-configuratie. In het onderste vetzuur zitten de waterstofatomen aan elkaars weerszijde ten opzichte van de dubbele binding. Dit is dus een trans-configuratie. De vetzuren krijgen hierdoor dus ook een andere naam zoals je kunt zien.
Wat zijn optische isomeren?
Optische isomerie kan ontstaan rondom asymmetrische atomen. Een atoom kan asymmetrisch zijn als het minimaal vier verschillende atomen/groepen aan zich gebonden heeft. Meestal is er sprake van een asymmetrisch C-atoom. Als er sprake is van optische isomerie, dan zitten dezelfde groepen aan een atoom vast, maar zijn ze op een andere manier gerangschikt. Je kunt deze moleculen op elke manier draaien, maar ze zullen nooit hetzelfde zijn.
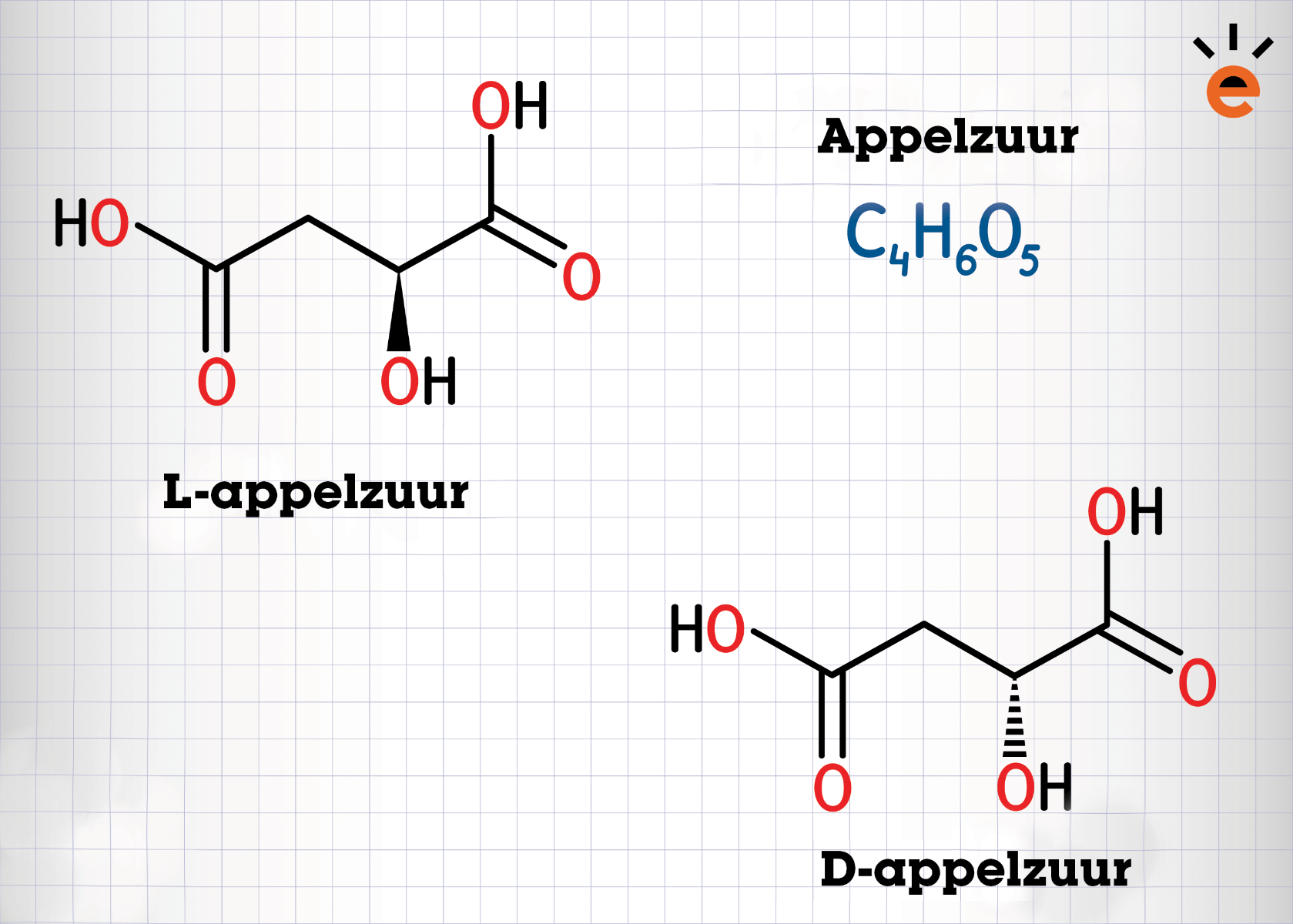
In de afbeelding hierboven zie je de optische isomeren van appelzuur. Er is één asymmetrisch atoom aanwezig en dat is het C-atoom, waar je de dikgedrukte en de gestippelde lijn met de OH-groep ziet zitten. De stippellijn betekent dat de OH-groep naar achteren is gericht en de dikgedrukte lijn betekent dat de OH-groep naar jou toe (naar voren) is gericht.
Op deze manier wordt er aangeven dat de OH-groep anders is gerangschikt. Je kunt de moleculen draaien, maar ze zullen nooit hetzelfde zijn, ondanks dat ze dezelfde molecuulformule hebben. Omdat deze binding eigenlijk het enige verschil is, liggen de stofeigenschappen van optische isomeren vaak wel bij elkaar in de buurt. De enige eigenschap waarmee je de stoffen wel kunt onderscheiden zijn de polarisatie-eigenschappen. Dat betekent dat het licht dat je erop schijnt op een andere manier wordt gedraaid. Men kan dit verschil meten en op die manier kunnen de isomeren worden onderscheiden.
Video
Wil je meer weten over isomeren? Bekijk dan zeker onderstaande uitlegvideo van Scheikundelessen: