Hydrofiel en hydrofoob
Zoals je misschien weet, bestaan er verschillende bindingen tussen moleculen en atomen. Dit worden ook wel chemische bindingen genoemd. Hierbij zijn atoombindingen vaak sterker dan de bindingen tussen moleculen. Bekende zwakke bindingen zijn Vanderwaalsbindingen en de sterkste bindingen zijn waterstofbruggen, ook wel H-bruggen genoemd. Deze waterstofbruggen verklaren het verschil tussen hydrofiel en hydrofoob. Wat is het verschil tussen deze twee nu precies? Dat leggen we je in dit artikel uit!

Wanneer is een stof hydrofiel?
Stoffen zijn hydrofiel wanneer ze door middel van het vormen van waterstofbruggen, goed in water oplossen. Het woord hydrofiel is van het Grieks afgeleid: hydro = water en fiel = vriend. Waterstofbruggen ontstaan dus bij O-H en N-H groepen. Dit komt doordat deze twee bindingen polair zijn. Polair betekent dat er op beide atomen een partiële lading zit. Bij de O en de N zit een partiële negatieve lading en bij de H zit een partiële positieve lading.
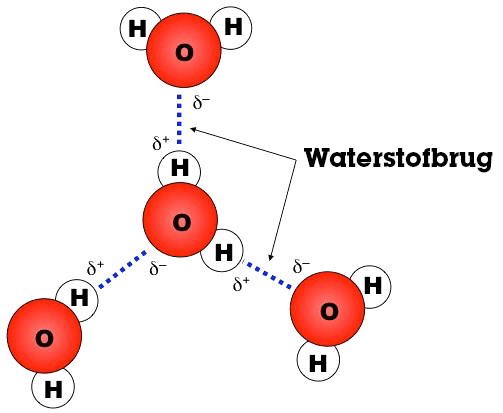
Op de afbeelding hieronder zie je hoe de partiële ladingen van de O en de H-atomen van water elkaar aantrekken en daardoor waterstofbruggen vormen.
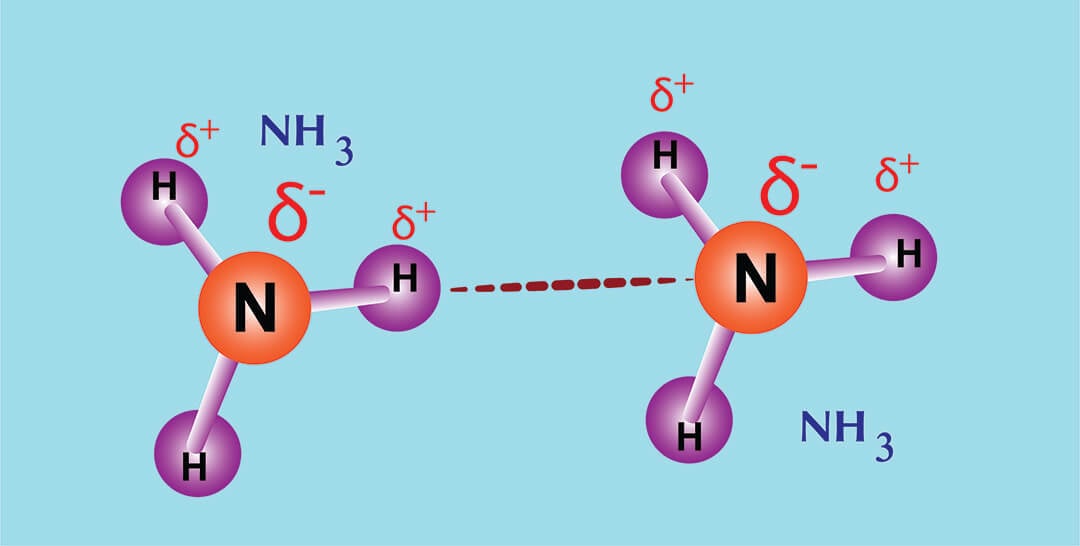
En op onderstaande afbeelding zie je hoe de N en de H-atomen van stikstof elkaar aantrekken en op die manier een waterstofbrug vormen.
Als je weet dat een stof hydrofiel is, weet je dus dat het kan oplossen in water. Daarnaast weet je ook meteen dat hydrofiele stoffen met elkaar kunnen oplossen. Polaire stoffen lossen namelijk goed op met polaire stoffen.
Wanneer is een stof hydrofoob?

Stoffen zijn hydrofoob wanneer ze geen waterstofbruggen kunnen vormen met water en daardoor niet goed oplossen in water. Ook de term hydrofoob is van het Grieks afgeleid: hydro = water en foob = angst. Omdat hydrofobe stoffen geen waterstofbruggen kunnen vormen, bevatten ze dus ook geen O-H en N-H groepen. Sterker nog, hydrofobe stoffen zijn eigenlijk apolair. Dit betekent dat er geen partiële ladingen aanwezig zijn en het molecuul eigenlijk altijd neutraal geladen is. Hierdoor kunnen er geen polaire bindingen ontstaan. Hydrofobe stoffen lossen ook goed met elkaar op, omdat apolaire stoffen goed met apolaire stoffen oplossen.
Hydrofiele en hydrofobe structuren
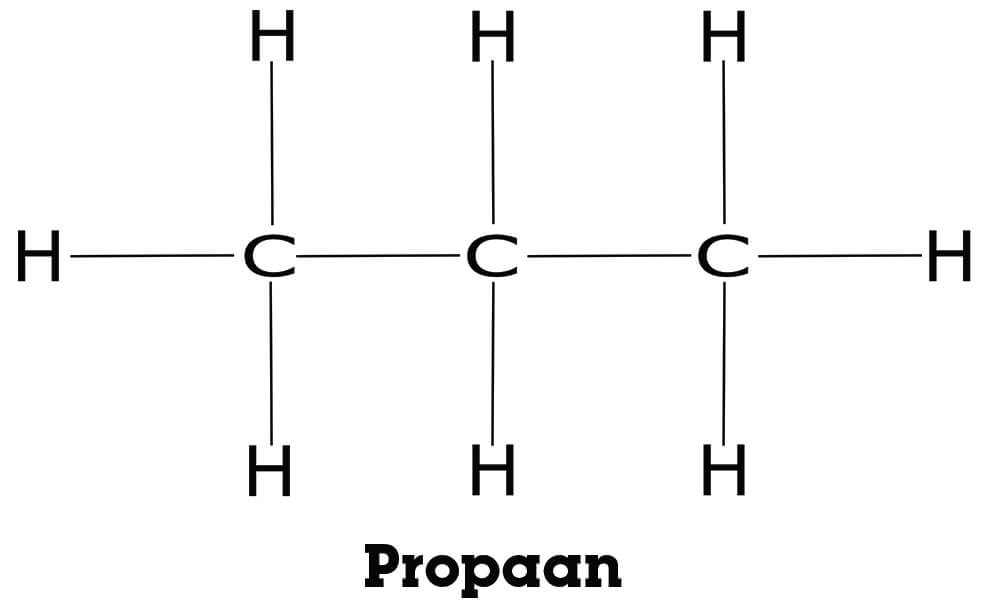
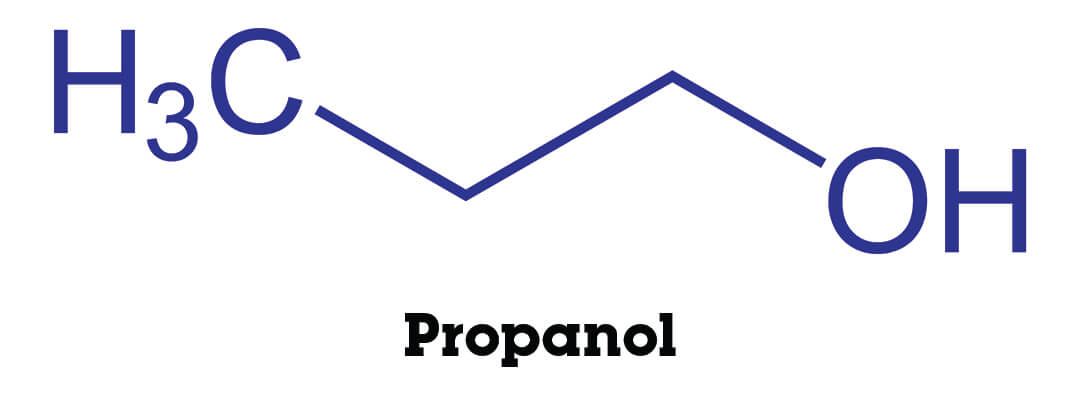
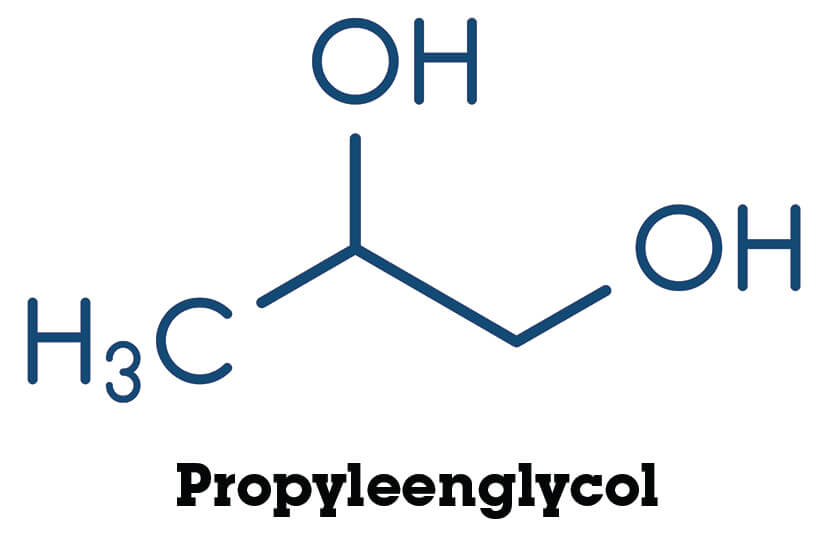
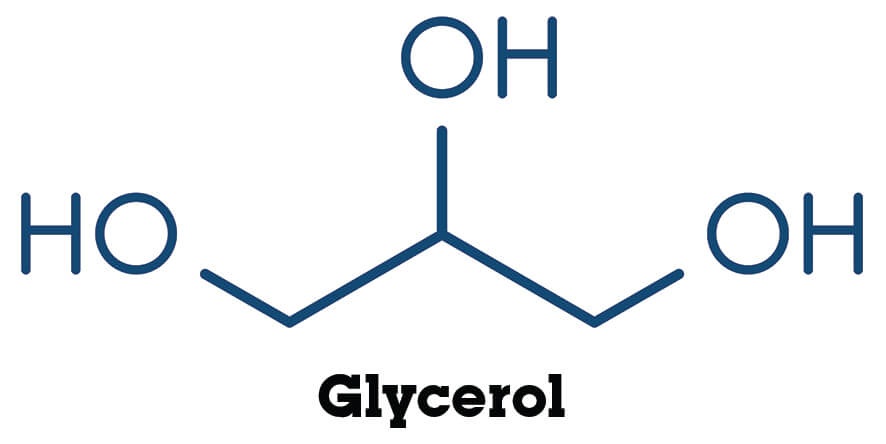
De ene stof lost makkelijker op in water dan de andere, ook al lijken de stoffen soms best veel op elkaar. Hieronder zie je propaan en drie alkanolen die van propaan gemaakt kunnen worden. Ze zijn weergeven in structuurformules.
Propaan is apolair, aangezien het alleen C-H bindingen heeft. Het zal dus niet mogelijk zijn om waterstofbruggen te vormen en lost daarom niet op in water. Een hydrofobe stof dus.
Propanol heeft één polaire O-H binding, dus deze kan een waterstofbrug vormen met een watermolecuul. Het is daarom een hydrofiele stof.
Propyleenglycol lijkt erg op propanol, maar het valt je misschien op dat het twee polaire O-H bindingen heeft. Dit betekent dat het ook twee waterstofbruggen kan vormen. Het zal daarom nog beter in water oplossen dan propanol. Dit is dus een hydrofiele stof.
Nu kan er zelfs nog een O-H binding bij komen, deze stof wordt glycerol genoemd. Het heeft drie polaire O-H bindingen en kan dus drie waterstofbruggen vormen. Het lost dan ook heel goed op in water. We hebben hier dus te maken met een hydrofiele stof.
Wat zijn emulgatoren?
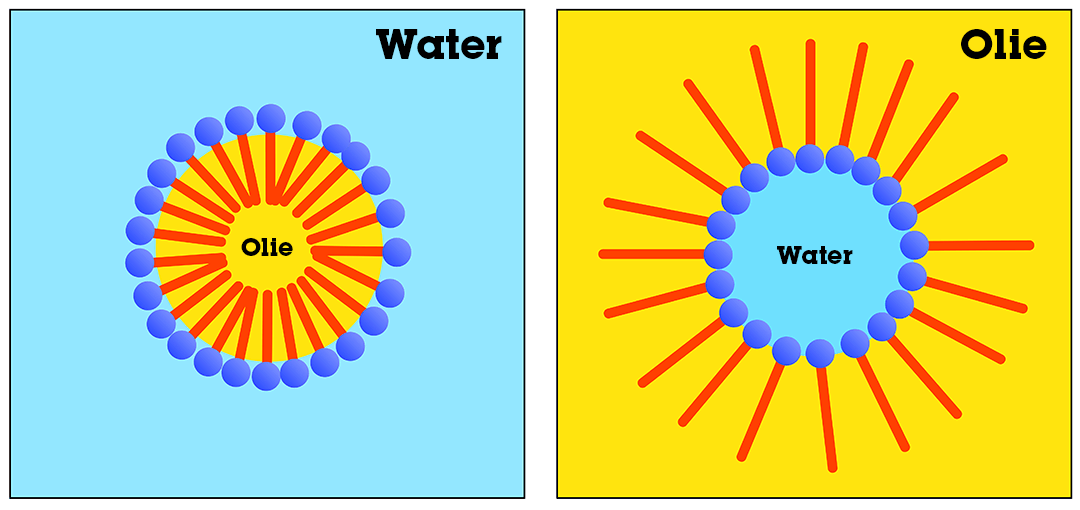
Emulgatoren zijn stoffen die het met hun unieke structuur mogelijk maken om een hydrofiele stof goed met een hydrofobe stof te laten oplossen. De unieke structuur heeft namelijk een deel dat hydrofiel is en een deel dat hydrofoob is. In de afbeelding hieronder kun je dat zien. De ronde kop is het hydrofiele gedeelte en de lange staart is hydrofoob. Op de linker afbeelding zie je een olie-in-water oplossing. Daar zie je dat de koppen met het water binden en de staarten met de hydrofobe olie. Normaal zou er een emulsie ontstaan, omdat water en olie niet met elkaar oplossen. Nu zal de olie als hele druppeltjes door het water zweven. Dit noem je ook wel micellen. Op de rechter afbeelding zie je een water-in-olie oplossing waarbij de staarten met de olie binden en de koppen met het water.
Een voorbeeld van een emulgator is zeep. Het heeft een hydrofobe staart die met het vuil op je handen zal binden en een hydrofiele kop die met het water zal binden. Zo lost het vuil goed op met de zeep en wordt het weggespoeld door het water.
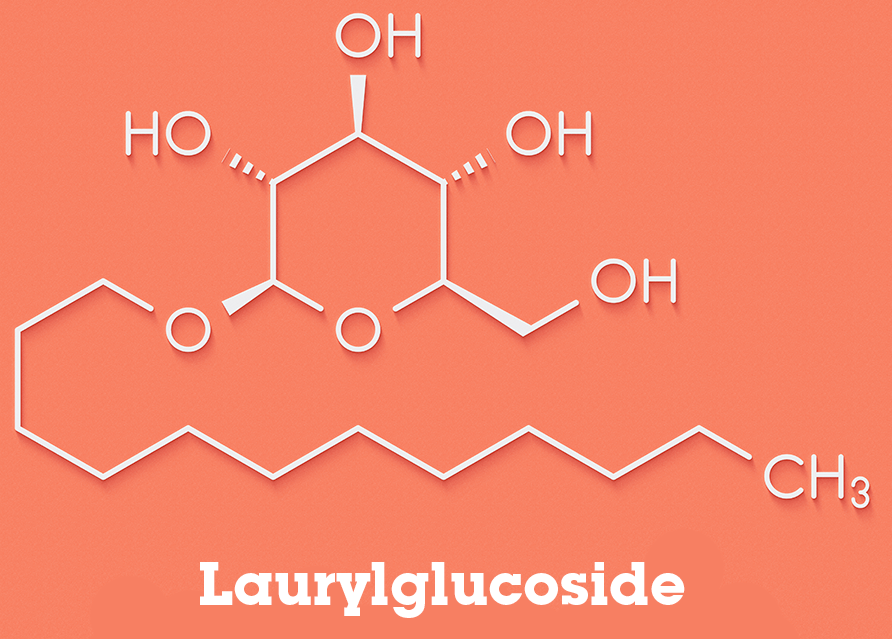
Een ander voorbeeld van een stof met zowel hydrofiele als hydrofobe eigenschappen is ‘Lauryl glucoside’. Deze stof wordt vaak gebruikt in cosmetica producten. In de afbeelding hieronder kun je zien dat de lange staart alleen apolaire C-H bindingen heeft. Dit is het hydrofobe deel van de stof. De ronde kop is het hydrofiele deel, aangezien het veel polaire O-H bindingen heeft die allemaal in staat zijn om waterstofbruggen te vormen.
Video
Wil je meer weten over hydrofiele en hydrofobe stoffen? Bekijk dan zeker even deze uitlegvideo van Scheikundelessen: