Endotherme en exotherme reacties
Endotherme en exotherme reacties hebben alles te maken met de toevoer en afgifte van energie tijdens het verloop van een reactie. Zoals je misschien wel weet, kan er pas een reactie plaatsvinden als atomen energie gaan uitwisselen. Deze uitwisseling van energie ontstaat alleen als atomen bewegen en botsen, waardoor er nieuwe stoffen ontstaan. Deze uitwisseling van energie is erg belangrijk voor bijvoorbeeld grote energiebedrijven, aangezien het een grote rol in het rendement speelt. Na het lezen van dit artikel weet jij wat het verschil is tussen endotherme en exotherme reacties.

Wat zijn endotherme en exotherme reacties?

Een endotherme reactie is een reactie waarbij energie nodig is om de reactie te laten verlopen. Er moet voortdurend energie worden toegevoerd, waardoor het eindniveau van energie hoger is dan het beginniveau. De reactie-energie van een endotherme reactie is positief. Oftewel, deze reacties hebben een positieve reactiewarmte.
Een exotherme reactie is een reactie waarbij energie vrijkomt, bijvoorbeeld in de vorm van warmte of licht. Hierdoor is het eindniveau van de energie lager dan het beginniveau. Bij exotherme reacties is de reactie-energie negatief. Ook wordt dit wel een negatieve reactiewarmte genoemd.
Hieronder zie je een reactiediagram. Dit is een diagram waarin het energieverloop van een reactie wordt weergegeven. We laten hier een reactiediagram zien van een exotherme en een endotherme reactie:
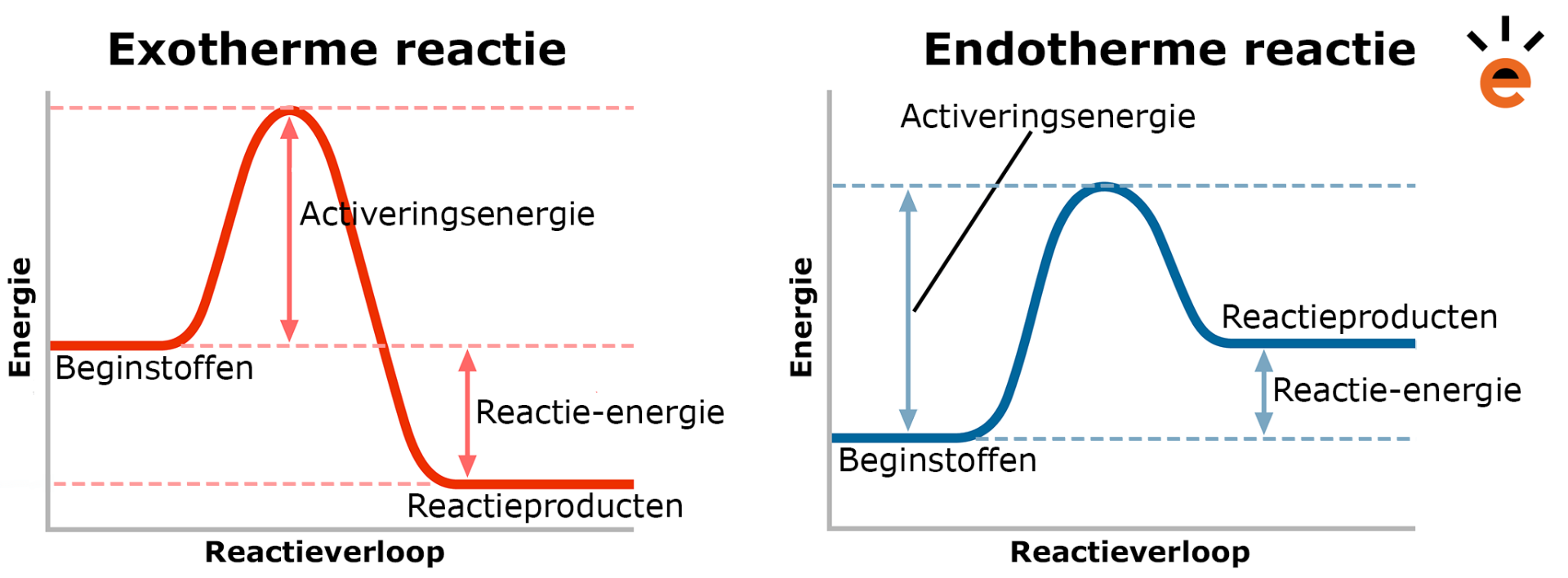
De grafiek van de exotherme reactie begint met een horizontale lijn. Dit geeft het energieniveau van de beginstoffen aan. Zoals je ziet verloopt de exotherme reactie op het begin hetzelfde als de endotherme reactie. Aangezien de het energie-niveau aan het begin halverwege staat, is er dus activeringsenergie nodig. Deze energie is dus nodig voor de overgangssituatie van beginstoffen naar de activeringstoestand. Elke reactie heeft een bepaalde activeringsenergie nodig om de reactie te laten verlopen. Denk bijvoorbeeld aan het aansteken van een lucifer. Er is een kleine warmte nodig om de lucifer aan te steken, maar vervolgens blijft hij branden.
Vanaf de activeringstoestand loopt de grafiek van de exotherme reactie naar beneden en komt er dus energie vrij. Hier is het verschil met de endotherme reactie te zien. Het energieniveau van de reactieproducten ligt lager dan dat van de beginstoffen. Dus in tegenstelling tot de endotherme reactie, komt hier energie vrij en wordt dit aan de omgeving afgegeven. Deze energie zit dus niet in de reactieproducten maar ‘verdwijnt’ in de omgeving, waardoor het energieniveau lager ligt dan de beginstoffen. Voor een exotherme reactie hoeft er dus niet constant energie toegevoerd te worden, maar komt er constant energie vrij.
Bij endotherme reacties wordt er energie toegevoegd. Echter, voordat de beginproducten nieuwe stoffen kunnen gaan vormen, zal het in losse atomen moeten worden ontleed. Op deze manier worden de bindingen van de beginstoffen verbroken om plaats te maken voor nieuwe bindingen. Om deze ontleding te laten plaatsvinden, is er weer activeringsenergie nodig. Vervolgens kan het vanuit de activeringstoestand nieuwe stoffen gaan vormen, de eindproducten. Zoals je in het diagram ziet, loopt de energie vanaf hier naar beneden. Dit betekent dat er energie vrijkomt. Er komt energie vrij totdat de grafiek weer een horizontale lijn is. Dit is het energieniveau van de eindproducten. Omdat we hier te maken hebben met een endotherme reactie, is de energie van de reactieproducten hoger dan de energie van de beginstoffen. Volgens de wet van behoud van energie moet deze energie van buitenaf zijn gekomen. Voor een endotherme reactie zal er dus altijd energie van buitenaf nodig zijn om de reactie te laten verlopen.
Wat is een katalysator?

Een katalysator is een stof die zelf niet wordt verbruikt, maar die er wel voor zorgt dat de activeringsenergie van een reactie wordt verlaagd. In je lichaam heb je bijvoorbeeld veel katalysatoren. Zo is elk enzym in het menselijk lichaam een katalysator. Deze helpen jouw cellen om reacties sneller te laten verlopen.
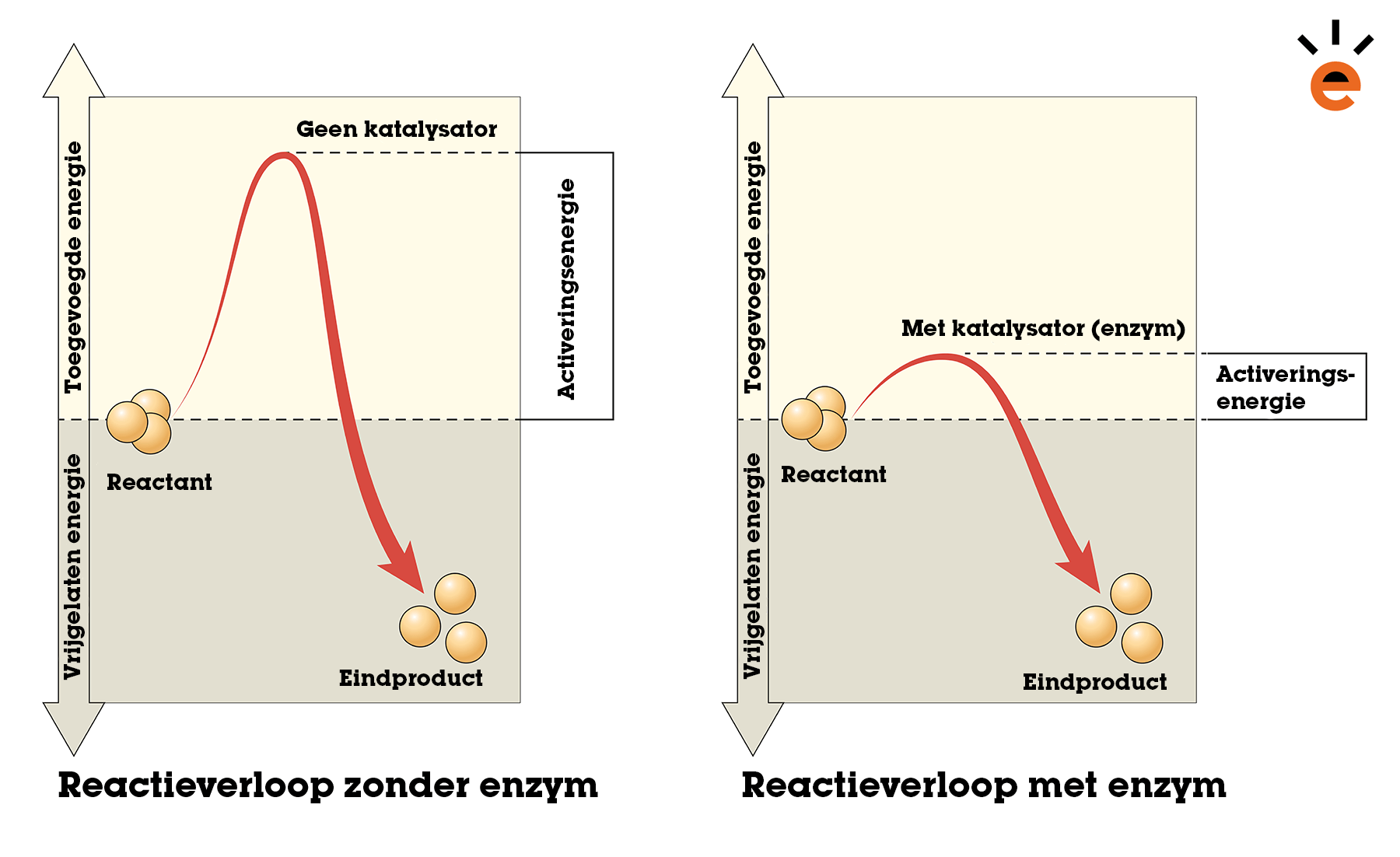
In bovenstaand figuur kun je het verschil zien tussen een exotherme reactie met en zonder katalysator. Links is er geen katalysator aanwezig en de activeringsenergie is dus ook hoog. Rechts is er wel een katalysator (enzym) aanwezig en de activeringsenergie is een stuk lager. De reactie zal dus veel makkelijker verlopen.
Hoe reken je met energiediagrammen?
Het rekenen met energieën is niet makkelijk. Gelukkig is er een stappenplan dat je altijd kunt gebruiken als je met energiediagrammen gaat rekenen:
- Vind de ontledingswarmtes van de beginstoffen en tel ze bij elkaar op
- Vind de vormingswarmtes van de reactieproducten en tel deze ook bij elkaar op
- Reken het verschil tussen de totale ontledingswarmte en de totale vormingswarmte uit: ontledingswarmte - vormingswarmte = reactiewarmte (verschil in energie begin vs eind)
- Een exotherme reactie heeft een negatieve reactiewarmte en een endotherme reactie heeft een positieve reactiewarmte.
Wat is het energie-effect?
Het energie-effect van een reactie is het verschil tussen de energieniveaus van de begin- en eindproducten. Dit verschil wordt veroorzaakt door de uitwisseling van energie tussen de atomen die reageren. Nu is het belangrijk om te beseffen dat er in een reactie niet zomaar energie kan bijkomen of kan verdwijnen. Dit heeft te maken met de wet van behoud van energie, waarin wordt gesteld dat de totale hoeveelheid energie in een geïsoleerd systeem altijd constant blijft. Dus als er bijvoorbeeld energie nodig is voor een reactie, zal dit van buitenaf moeten worden toegevoerd.
De rol van endotherme en exotherme reacties in de praktijk
Je kunt je voorstellen dat het voor grote energiebedrijven essentieel is om het energieverloop goed te onderzoeken. Er kan namelijk veel energie verloren gaan bij het produceren van bepaalde stoffen. In dat geval beïnvloedt de warmte die verloren gaat het rendement van het proces. Maar ook grote kerncentrales hebben baat bij een goede kennis over het energieverloop. Als er energie wordt opgewekt door bijvoorbeeld exotherme kernsplijting, kan er heel veel energie vrijkomen. Als deze exotherme reactie dan niet voldoende wordt gecontroleerd, kan er zoveel energie vrijkomen dat de centrale explodeert.
Video
Wil je meer uitleg over endotherme en exotherme reacties? Bekijk dan zeker even deze video van Scheikundelessen:












