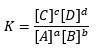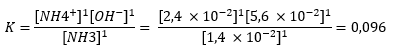Zuur-base reacties
Een zuur-base reactie is simpelweg een reactie tussen een zuur en een base. Aangezien er veel verschillende soorten zuren en basen zijn, zijn er ook veel verschillende soorten zuur-base reacties. Wat komt er allemaal bij zuur-base reacties kijken? Dat lees je in dit artikel!

Video
Wil je meer weten over zuur-base reacties? Bekijk dan zeker even de volgende uitlegvideo van Scheikundelessen:
Hoe reageren zuren en basen op elkaar?

Als je twee stoffen bij elkaar doet, zal de sterkste base reageren met het sterkste zuur. Of een zuur al zijn protonen zal afstaan in een reactie, kun je vinden in Binas tabel 49.
Sterk zuur
Stel je, je voegt waterstofchloride (HCl) toe aan een waterige oplossing. HCl zal een reactie met het water aangaan. Maar zal HCl als zuur of als base gaan reageren? En hoe reageert het water?
Als je Binas tabel 49 erbij pakt, zie je dat HCl bovenaan in de zurentabel staat. Omdat HCl een sterk zuur is, zal het ook als zuur gaan reageren. H2O reageert dan als base. Je kunt aan de andere kant van het desbetreffende zuur of base zien wat het eindproduct is van de reactie. HCl zal Cl– worden en H2O zal H3O+ worden. Daarom ziet de reactievergelijking er als volgt uit:
HCl + H2O => Cl– + H3O+
Zwak zuur
Nu voegen we waterstofsulfaat (HSO4-) toe aan een waterige oplossing. HSO4- staat redelijk hoog in de zurentabel van Binas. Het staat hoger in de zurentabel dan water, en daarom zal HSO4- als zuur reageren. Sommige stoffen staan zowel in de zurentabel als in de basentabel. Om erachter te komen hoe de stof zal reageren, moet je kijken naar waar die stof in de tabel staat. HSO4- staat bijvoorbeeld hoog in de zurentabel en bij de basen staat het als een hele zwakke base. Het zal dan als zuur gaan reageren.
Als HSO4- als zuur reageert, zal het SO42– worden. En als water als base reageert, zal het H3O+ worden. Omdat we met een zwak zuur en een zwakke base te maken hebben, zal er een evenwichtsreactie ontstaan. De evenwichtsreactie ziet er als volgt uit:
HSO4- + H2O <=> SO42– + H3O+
Sterke base
Stel, we voegen azanide (NH2-) toe aan een waterige oplossing. Azanide staat in de basentabel van Binas als een sterke base. Dat betekent dat het in de reactie met water als een sterke base zal gaan reageren. Het NH2- zal NH3 worden en het H2O zal OH– worden. De reactie is aflopend aangezien NH2- een sterke base is en dus alle protonen die beschikbaar zijn zal opnemen:
NH2- + H2O => NH3 + OH–
Zwakke base
Nu voegen we ammonia (NH3) toe aan een waterige oplossing. ammonia staat in de basentabel van Binas als een zwakke base. NH3 kun je vinden op de rechterpagina van de basentabel. Het staat ook bij de zuren als een heel zwak zuur (onderaan). Het zal als een base reageren en het water als een zuur. Het NH3 zal NH4+ worden en het H2O zal OH– worden. Het is een evenwichtsreactie, want we hebben te maken met een zwakke base:
NH3 + H2O <=> NH4+ + OH–
Wat is de evenwichtsconstante (K)?

De evenwichtsconstante (K) geeft aan in welke richting een evenwichtsreactie verloopt. De zwakke zuren en zwakke basen hebben verschillende sterktes. Dit kan je terugzien in Binas tabel 49, aangezien het ene zwakke zuur hoger staat dan het andere. Voor basen geldt hetzelfde.
Wanneer je te maken hebt met een sterk zuur of een sterke base, ligt het evenwicht helemaal naar rechts. Daarom is de reactie aflopend. In de tabel zie je dat de zuur- en baseconstante hiervan hoger zijn dan 1. Bij zwakke zuren en zwakke basen liggen deze waardes tussen de 0 en de 1. Hoe dichter bij de 1, hoe meer de desbetreffende reactie naar rechts ligt.
Hoe bereken je de evenwichtsconstante van een zuur-base reactie?

De formule voor de evenwichtsconstante ziet er als volgt uit:
aA + bB <=> cC + dD
Zoals je kunt zien staan de concentraties van de eindproducten (C en D) bovenaan de breuk en de concentraties van de beginstoffen (A en B) onderaan de breuk. De blokhaken betekenen dus dat het gaat om de concentratie van de stoffen. De kleine letters geven het aantal mol aan van de desbetreffende stof. Deze vul je in de macht van de concentratie in.
- Als K > 103 is het een aflopende reactie
- Als 10–3 < K <103 is het een evenwichtsreactie
- Als K < 10-3 is er nagenoeg geen reactie
Nu is het vaak zo dat water in de zuur-base reactie een beginstof is. Voor zuivere stoffen zoals water is de evenwichtsconstante gelijk aan 1. Water hoef je dus niet mee te nemen in de evenwichtsconstante van de reactie.
Stel, we hebben de volgende reactie:
NH3 + H2O <=> NH4+ + OH–
De concentraties zijn als volgt:
[NH3] = 1,4 × 10–2 mol/L , [NH4+] = 2,4 × 10–2 mol/L en [OH–] = 5,6 × 10–2 mol/L.
Wat is de evenwichtsconstante?
Van elke aanwezige stof is er 1 mol aanwezig dus de machten zullen allemaal 1 zijn. De uiteindelijke evenwichtsconstante is 0,096, wat duidt op een evenwichtsreactie (10-3 < K < 103).
Hoe bereken je de pH en de pOH?
De pH en de pOH bereken je door gebruik te maken van de aanwezige [H3O+] en [OH–] in de oplossing. De [H3O+] gebruik je om de pH te berekenen en de [OH–] gebruik je om de pOH te berekenen.
pH = –log ([H3O+])
pOH = –log ([OH–])
Ook is er een verband tussen de pH en de pOH:
pH = 14 – pOH
Laten we de pH berekenen van de reactie waar we ook de evenwichtsconstante voor hebben berekend. De [H3O+] is in eerste instantie niet bekend. De [OH–] wel, deze is namelijk 5,6 × 10–2 mol/L. We kunnen nu als eerste de pOH berekenen om vervolgens de pH te berekenen.
pOH = –log ([5,6 × 10–2]) = 1,25
pH = 14 – pOH = 14 – 1,25 = 12,75
De pH is 12,75, wat duidt op een heel basische oplossing. Dat is juist, want er zijn OH--ionen in de oplossing aanwezig.